ソセゴン®注射液15mg
基本情報
| 発売開始 | 2012年10月 |
|---|---|
| 日本薬局方/ 規制区分 |
劇向習処 |
- 日本薬局方
- 劇薬
- 毒薬
- 向精神薬
- 習慣性医薬品
- 処方箋医薬品
- 後発品
- 基礎的医薬品
- 第2類医薬品(指定第2類医薬品の取扱いはありません)
- 第3類医薬品
製品資料一括ダウンロード
※くすりのしおりはダウンロードされません。
各種コード
容量: 15mg 1mLX10A
| 薬価基準収載医薬品コード | 1149401A1027 | |
|---|---|---|
| 個別医薬品(YJ)コード | 1149401A1027 | |
| レセプト電算処理コード |
銘柄別 641140051 統一名 000000000 |
|
| HOT番号 | 1010862020101 | |
| JANコード | 4987211135331 | |
| 統一商品コード | 211-135331 | |
| GS-1コード | 調剤包装単位コード | (01)04987211235338 |
|---|---|---|
| 販売包装単位コード | (01)14987211135338 | |
| 元梱包装単位コード | (01)24987211135335 |
本製品に関するお知らせ
- すべて
- 包装変更・その他
- 使用上の注意改訂等
- 流通状況
-
流通状況 NEW出荷状況一覧表(3月2日現在)
-
流通状況 NEWソセゴン®注射液 供給状況に関するお知らせ
-
流通状況出荷状況一覧表(1月19日現在)
-
流通状況出荷状況一覧表(12月10日現在)
-
流通状況ソセゴン®注射液 限定出荷のお知らせ
-
包装・表示ソセゴン®注射液15mg・ソセゴン®注射液30mg使用期限短縮(5年→3年) および包装変更のお知らせに関するお詫びとお知らせ
-
包装・表示ソセゴン®注射液15mg・ソセゴン®注射液30mg 使用期限短縮(5年→3年)および包装変更のお知らせ
-
使用上の注意ソセゴン®注射液15mg・30mg、ソセゴン®錠25mg 使用上の注意改訂のお知らせ
-
包装・表示1mL×50A 可変表示対応済み個装箱を掲載しました。(Lot;7Z061~)
-
包装・表示1mL×10A 可変表示対応済み個装箱を掲載しました。(Lot;7Z011~)
-
包装・表示1mL×50A 新バーコード表示対応済み個装箱及び調剤ラベルを掲載しました。(Lot;56101~)
-
包装・表示1mL×10A 新バーコード表示対応済み個装箱及び調剤ラベルを掲載しました。(Lot;56121~)
-
新発売「ソセゴン注射液15mg」新発売のお知らせ
-
包装・表示ソセゴン®注射液15mg・ソセゴン®注射液30mg使用期限短縮(5年→3年) および包装変更のお知らせに関するお詫びとお知らせ
-
包装・表示ソセゴン®注射液15mg・ソセゴン®注射液30mg 使用期限短縮(5年→3年)および包装変更のお知らせ
-
包装・表示1mL×50A 可変表示対応済み個装箱を掲載しました。(Lot;7Z061~)
-
包装・表示1mL×10A 可変表示対応済み個装箱を掲載しました。(Lot;7Z011~)
-
包装・表示1mL×50A 新バーコード表示対応済み個装箱及び調剤ラベルを掲載しました。(Lot;56101~)
-
包装・表示1mL×10A 新バーコード表示対応済み個装箱及び調剤ラベルを掲載しました。(Lot;56121~)
-
新発売「ソセゴン注射液15mg」新発売のお知らせ
-
流通状況 NEW出荷状況一覧表(3月2日現在)
-
流通状況 NEWソセゴン®注射液 供給状況に関するお知らせ
-
流通状況出荷状況一覧表(1月19日現在)
-
流通状況出荷状況一覧表(12月10日現在)
-
流通状況ソセゴン®注射液 限定出荷のお知らせ
本製品に関するよくあるご質問
- 血管外漏出時の対処法は?
本剤に特有の対処法はありません。注射剤が血管外漏出した際は、患部を冷やす(冷罨法)などの一般的な対処法と同様の処置をお願いします1)。
一般的な対処法の例2)
1.点滴を中止し、薬液を吸引する。(薬液が明らかに溜まっている場合)
2.漏出数時間後:患部の冷却
3.消炎鎮痛作用のある外用薬(湿布、軟膏等)、ステロイド外用薬の使用参考資料
1)葛西英子:日本看護技術学会誌 2014;13(3):230-6.
https://www.jstage.jst.go.jp/article/jsnas/13/3/13_230/_pdf/-char/ja
2)診断と治療 1999;87(増刊号):289.
- 併用注意に「本剤は高用量において、モルヒネの作用に拮抗することがある」と記載されていますが、具体的な量はどれくらいですか?
モルヒネに対して拮抗作用を示すソセゴンの具体的な臨床用量は不明です。
複数の動物実験の結果から、モルヒネが低用量の場合にはソセゴンが協力作用を、モルヒネが高用量の場合は拮抗作用を示すといわれています。
また、この拮抗作用はペンタゾシンの用量に比例しているといわれています1)2)。
臨床の場で併用あるいは切り換える場合は、個々の患者さんの痛みの状況を投与後注意深く観察することが必要です。参考文献
1)IIZUKA H et al.:Pharmacology Biochemistry and Behavior 1984;20:531-5.【SO0840001】
2)柳田知司 他:臨床薬理 1985;16(1):87-8.【SO0850026】
- 鎮痛目的で用いる際に静脈内注射できない理由は?
「鎮痛」の効能は、ソセゴン注射液15mgのみにあり、投与方法は筋肉内注射あるいは皮下注射で、静脈内注射は適応外使用になります。
発売当時は「鎮痛」の効能にも静脈内注射がありましたが、死亡例等を含め、静脈内注射による副作用が頻発し、これらの副作用軽減対策として、1970年12月に副作用調査会(当時の厚生省)から鎮痛の目的で用いる場合の「1回30mg」、「静脈内注射」を削除する旨検討の指示があり、1971年に添付文書を改訂しました。
なお 「麻酔前投薬及び麻酔補助」には静脈内注射の用法もあります。これは、呼吸抑制等の副作用が起きても麻酔医により呼吸管理が実施できるためです。
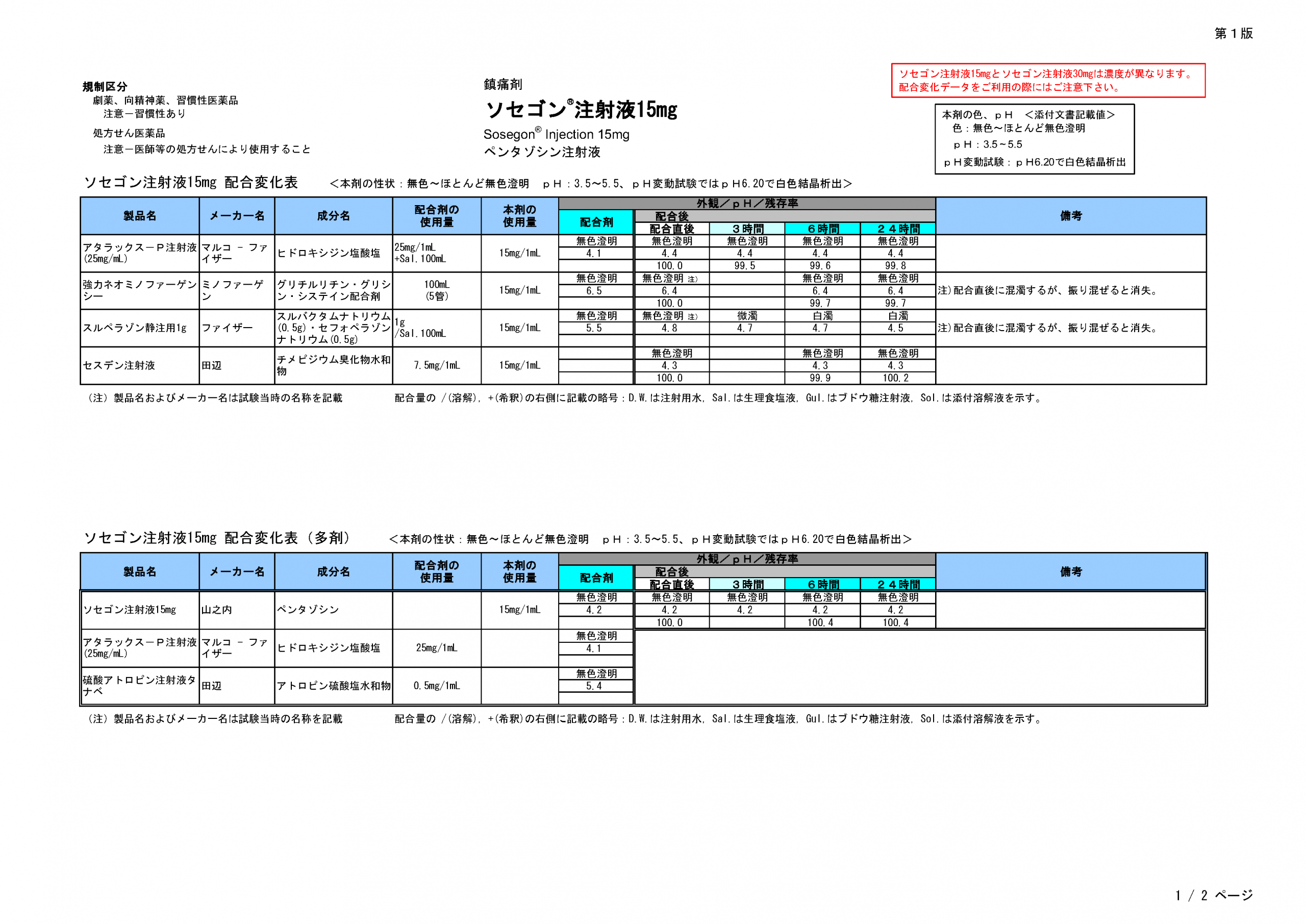
- 配合変化表はありますか?
ございます。こちら
からダウンロードしていただけます。
なお、ソセゴン注30mgの配合変化表もご参照ください。
- 薬物依存はどれ位の投与量、期間で引き起こされますか?
薬物依存を引き起こすソセゴンの投与量および投与期間は不明です。
当時の厚生省が発表した注射剤(非経口投与)による依存例についての症例一覧1)によると、個人差が大きいと考えられ、投与量、期間から薬物依存を予想することはできません。参考資料
1)厚生省薬務局安全課:医薬品副作用要覧.ミクス,187-95.
- 筋肉注射した後に揉んだ方がいいですか?揉まない方がいいですか?
注射剤の中には、マイクロカプセル等の徐放性製剤で注射部位を揉んではいけない製品もありますが、ソセゴン注射液はそのような特殊な薬剤ではありません。
一般的な方法として、注射部位をアルコール綿で押さえて軽くマッサージをして下さい。
- 授乳婦に投与した場合の母乳への移行性、授乳再開期間を教えてほしい。
ソセゴン錠、ソセゴン注の電子添文 9.特定の背景を有する患者に関する注意 9.6授乳婦 には「治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。」と記載されています。
授乳期にペンタゾシンを投与した結果を報告した文献はなく、授乳中の乳児への薬剤の影響は不明です。経口投与では、産婦6例にペンタゾシン錠50mgを産褥2日目に投与した場合、ペンタゾシンは乳汁中に1時間で現れ、5例は約3時間で最大になり、24時間で1時間値より低下し、5例は48時間で全く認められなくなった報告1)があります。
また、注射剤においても、安全性を考慮して半減期の5倍の期間は授乳を避けるべきと考え、授乳再開までの期間は、投与方法により最終投与時点から、表の間隔(半減期の5倍)をあければよいと考えられます。
投与方法 ペンタゾシン投与量 ペンタゾシンの半減期2)(時間) 半減期の5倍(時間) 筋注(臀筋内) 0.5mg/kg 1.28±0.71 6.4 1mg/kg 2.02±0.50 10.1 静注 0.5mg/kg 0.73±0.60 3.65 参考資料
1)沼田正広、他:日本産科婦人科学会 関東連合地方部会誌 1975;第22号:33-4.【SO0750040】
2)荒川佳子、他:麻酔 1981;30(4):356-61.【SO0810033】
- 相互作用の併用注意に「モルヒネ製剤」がありますが、フェンタニルとの相互作用はどうですか?
薬理学的にどのように作用するかは不明ですが、フェンタニルのオピオイドμ受容体に対する選択性は高く、完全作動薬として作用するため、フェンタニルの濃度が高い場合、ペンタゾシンが共存するとモルヒネ同様に競合的に拮抗して作用が減弱し、フェンタニルの濃度が低い場合は作用が増強する可能性が考えられます。
なお、ペンタゾシンとフェンタニルとの相互作用に関する報告はみあたりません。各オピオイドのオピオイド受容体タイプに対する結合親和性(結合しやすさ)
オピオイド μ受容体 δ受容体 κ受容体 コデイン + トラマドール +※ モルヒネ +++ + オキシコドン +++ フェンタニル +++ メサドン +++ タペンタドール + ペンタゾシン ++(P) + ++ ブプレノルフィン +++(P) ++(P) +++(P) (P)部分作動薬であることを示す
※トラマドール自体に結合親和性はなく、代謝物が部分作動薬として作用する参考資料
特定非営利活動法人 日本緩和医療学会 緩和医療ガイドライン作成委員会:がん疼痛の薬物療法に関するガイドライン2014年版.金原出版,2014,51.
- 廃棄方法は?
ソセゴン錠25mg、ソセゴン注射液15mg・30mgは、第2種向精神薬に該当します。したがって、廃棄は、焼却、酸、アルカリによる分解、希釈、他の薬剤との混合等、向精神薬の回収が困難な方法により行ってください。1,2)
また、廃棄する場合は品名(販売名)・数量、廃棄した年月日の記録が必要で、この記録を最終記載の日から2年間保存しなければなりません。ただし、患者への向精神薬の交付、施用、患者に交付された向精神薬の返却、返却を受けた向精神薬の廃棄については、記録の必要はありません。
なお、向精神薬が記載された伝票の保存をもって記録に代えることができますが、向精神薬が記載されていない伝票とは別に綴ってください。参考資料
1)厚生労働省医薬食品局監視指導・麻薬対策課:病院・診療所における向精神薬取扱いの手引,平成24年2月
(http://www.mhlw.go.jp/bunya/iyakuhin/yakubuturanyou/dl/kouseishinyaku_01.pdf)
2)厚生労働省医薬食品局監視指導・麻薬対策課:薬局における向精神薬取扱いの手引,平成24年2月
(http://www.mhlw.go.jp/bunya/iyakuhin/yakubuturanyou/dl/kouseishinyaku_02.pdf)
- ソセゴン注射液をシリンジにとった後の安定性を教えてください。
ソセゴン注射液は保存剤を含みませんので、開封後は無菌性の保証ができません。開封後は早期に使用して下さい。
またソセゴン注射液のアンプル開封後の安定性データはありません。
なお、開封後の使用期限は設定しておりません。
関連製品情報
お役立ちツール
各コンテンツ(動画・PDFなど)は、ダウンロードしてお使いいただけます。また、各資材は本サイトから発注できます。
一部ポスターを除き、編集・改変などはご遠慮ください。一部コンテンツは、medパスでのログインまたは新規登録が必要です。
手術/麻酔集中治療鎮痛
ソセゴン注射液®15mg 配合変化表
(2012年07月05日)
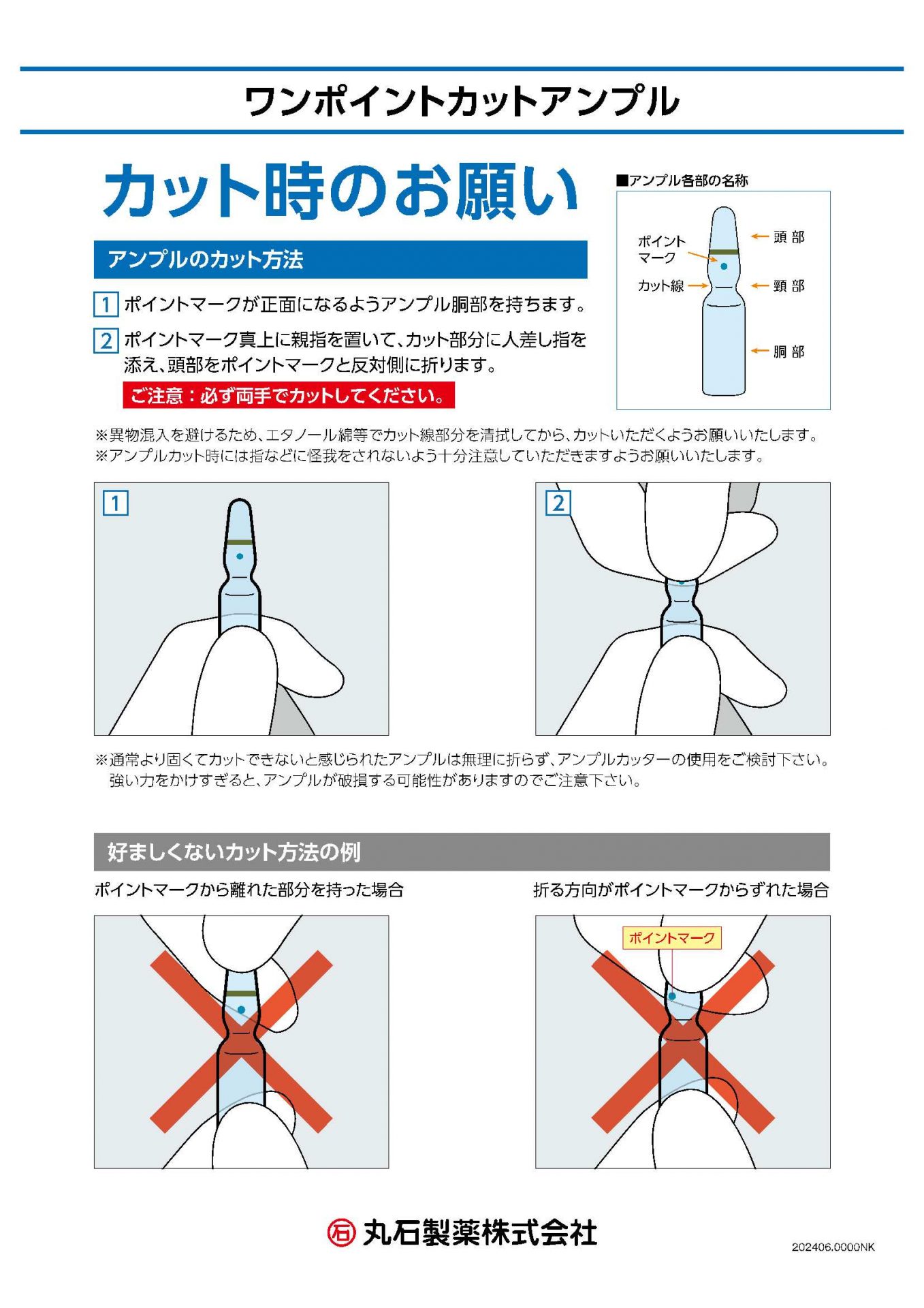
ワンポイントカットアンプル ーカット時のお願いー
(2024年06月03日)
くすりのしおり(日)
くすりのしおり(英)
資材をカートへ入れました。

![ソセゴン®錠25mg 100錠[10錠(PTP)×10]](https://www.maruishi-pharm.co.jp/medical/media/photo_sosegon__tablets_3.jpg)