事業活動
パートナリングPartnering
他の製薬企業や創薬ベンチャー、大学や研究機関などと連携し、共同研究や共同開発、ライセンスや販売提携など、さまざまな形態のパートナリングを展開しています。
開発品や製品の導入・承継を積極的に進めることで、製品パイプラインの充実を図り、実績を上げてきています。
また、「製品」「製造技術」「特許」「信頼」などの強みを活かし、他社との提携(販売提携・製造受託)により、新たなチャネルで、当社製品および相手先ブランドの製品を医療機関や一般のお客様に提供しています。
日本以外のマーケットにおいては、世界各国、各エリアに応じた適切なパートナーと協働し、海外のさまざまな地域に住む患者さんに、高品質の医薬品をお届けしています。
パートナーを組むことによって得られた成果を活かし、さらなる研究・開発へとつなげられるような好循環をめざして事業に取り組んでいます。
なかでも注力領域と定めているのは、周術期医療、感染対策、急性期・救急医療、支持医療(がんサポーティブケア)の分野です。
新たに当社とお取引を希望される企業さまは、下記お問い合わせフォームよりお問い合わせください。
-

ライセンス
-

販売提携
-

製造受託
 > 詳しくはこちら
> 詳しくはこちら
注力領域
- 周術期医療
- 感染対策
- 急性期・救急医療
- 支持医療(がんサポーティブケア)
主な製品
- アルコール含有製剤
- 各種消毒剤
- 外用剤(軟膏・液剤・滅菌製剤)
- 注射剤
営業Sales and Marketing
手術や処置時の麻酔、痛みの緩和、感染対策のための消毒を主な領域として、医薬品の情報提供と収集活動を行っています。また、古くから使用されているベーシックドラッグ(日本薬局方医薬品)の安定供給にも注力しています。
営業活動においては、エビデンスに基づく最新情報を迅速かつ正確に医療関係者へお届けし、医療関係者からの情報収集により、次の情報提供につながることを心がけています。
医薬品は、「高品質な製品」と「安全性・有効性・適正使用などの情報」が一つとなって、初めてその価値が発揮されるものと捉え、患者さんやそのご家族が安心して医療を受けられるよう、医療関係者との関係構築においてもコンプライアンス意識を高くもち、信頼していただける会社をめざしています。
研究・開発Research and Development
高度急性期・急性期を中心とした周術期・急性期・救急医療領域と感染対策領域、さらには支持医療(がんサポーティブケア)を主なターゲットとし、その周辺領域も含めた医療現場のアンメットニーズを満たせるよう、研究開発シーズの探索、基礎的な創薬研究、製剤設計、CMC関連試験、非臨床試験、臨床試験、さらには市販後の育薬に至る、一貫した研究開発活動に取り組んでいます。
研究開発シーズの探索としては、開発候補品の評価、各種薬理作用のスクリーニングおよび薬効メカニズムの解明、微生物を用いた有効性評価、代謝物・分解物などの合成研究を行っています。
そして、社内での基礎研究や外部との共同研究などから創出された開発候補化合物、ならびに他社からの導入化合物について、製品価値の最大化をめざした製剤設計を実施しています。
GLP(Good Laboratory Practice)や信頼性などの各種基準に適合した体制を整えて、医薬品申請に係る物理化学的研究、規格および試験方法の立案や各種安定性試験、各種非臨床試験を行っています。
さらに、非臨床研究で有効性および安全性が確認された候補化合物は、GCP(Good Clinical Practice)に従って、第1相試験から第3相試験へとヒトでの臨床試験をし、医薬品としての製造販売承認を取得しています。
これら自社製品やその周辺領域については、医学的・科学的情報に基づいて、エビデンス創出に向けた臨床研究や共同研究を支援し、市販後の育薬につなげています。
当社が開発中の新薬等の開発状況をまとめた「パイプライン情報」、ならびに、これら個々のパイプラインを、医薬品や医療機器として国(厚生労働省)の承認を得るために実施している臨床試験に関する情報をまとめた「治験情報」につきましては、それぞれ以下のリンクに掲載しています。
なお、掲載している情報は当社の医薬品の宣伝・広告を目的とするものではなく、患者さんやそのご家族、研究者、アカデミアのほか一般の方にも広く提供することを目的としています。
信頼性保証Quality, Safety and Regulatory Affairs
医薬品の信頼性確保のため、法令や各基準を専門に担当する品質保証部、安全性情報部、信頼性保証部と、薬事法規での業務サポートを行う薬制部が相互に連携のうえ、薬事管理体制を推進しています。
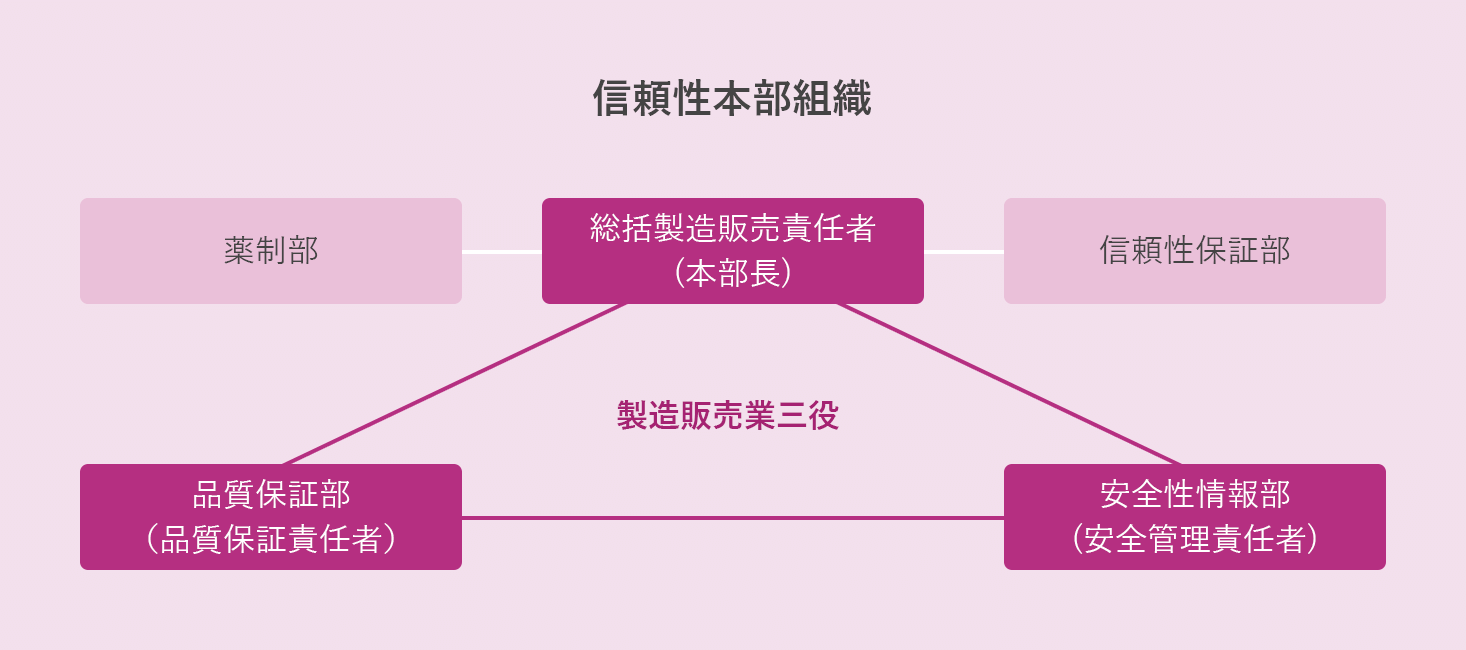
品質管理および安全管理は、総括製造販売責任者のもと、品質保証責任者ならびに安全管理責任者がGQP(Good Quality Practice)、GVP(Good Vigilance Practice)およびGPSP(Post-Marketing Study Practice)の基準に照らして、情報の収集・調査・評価・判断を継続的に実施しています。
必要に応じ適切な措置を講ずることで、承認された要件を満たし、安全で品質の高い医薬品を医療機関、ひいては患者様に安定して提供できるよう努めています。
開発中の医薬品の申請データに関しても、非臨床試験はGLP(Good Laboratory Practice)、信頼性基準および臨床試験はGCP(Good Clinical Practice)の基準に従って収集されていることを調査・監査し、申請資料の信頼性基準を満たせるよう保証体制を構築しています。
品質確保の更なる強化に向けて、「ICHQ10医薬品品質システムガイドライン」に則して「医薬品品質マニュアル」を定め、経営層参画による部門横断的なマネジメントレビューを通じて、評価や継続的な改善を行っています。
品質マネジメントシステムは、医薬品の原薬、製剤の開発、治験薬製造から商業生産のための技術移転に至る開発段階も適用範囲とするなど、製品の全ライフサイクルを対象にした取り組みを実践しています。
生産Production
主力工場である今津工場では、高品質の丸石ブランドを支える諸製品のうち、周術期医療領域を中心として感染対策領域、ベーシックドラッグの各カテゴリー約30品目を製造しています。
工場は、無菌製剤と一般製剤ゾーンに大別し、注射剤・内服固形剤・内用液剤・外用液剤・軟膏剤などの製造に対応しています。
麻酔剤・鎮痛剤・鎮静剤および軟膏などの主力製品は自動化された専用ラインを設け、高い生産性をもって安定供給に努めています。
また、グローバル化する改正GMP(Good Manufacturing Practice)、GDP(Good Delivery Practice)にも対応できるよう、より高度な品質システムの確立を追究し、徹底した品質管理のもとで行う、高品質な医薬品の製造と安定的な供給を軸とした生産体制で、製造した医薬品の先にいらっしゃる患者さんのために邁進しています。
