プロスタルモン®・F注射液1000 1mLX10A
基本情報
| 発売開始 | 2018年12月 |
|---|---|
| 日本薬局方/ 規制区分 |
日劇処 |
- 日本薬局方
- 劇薬
- 毒薬
- 向精神薬
- 習慣性医薬品
- 処方箋医薬品
- 後発品
- 基礎的医薬品
- 第2類医薬品(指定第2類医薬品の取扱いはありません)
- 第3類医薬品
製品資料一括ダウンロード
※くすりのしおりはダウンロードされません。
各種コード
容量: 1mLX10A
| 薬価基準収載医薬品コード | 2499401A2050 | |
|---|---|---|
| 個別医薬品(YJ)コード | 2499401A2050 | |
| レセプト電算処理コード |
銘柄別 642490022 統一名 000000000 |
|
| HOT番号 | 1055375020101 | |
| JANコード | 4987211351113 | |
| 統一商品コード | 211-351113 | |
| GS-1コード | 調剤包装単位コード | (01)04987211451110 |
|---|---|---|
| 販売包装単位コード | (01)14987211351110 | |
| 元梱包装単位コード | (01)24987211351117 |
本製品に関するお知らせ
- すべて
- 包装変更・その他
- 使用上の注意改訂等
- 販売中止
-
適正使用・注意喚起プロスタルモン®・F注射液1000 適正使用に関するお願い
-
適正使用・注意喚起プロスタルモン®・F注射液1000・2000「適正使用」に関するお願い
-
販売中止プロスタルモン®・F注射液2000 販売中止のお知らせ
-
適正使用・注意喚起プロスタルモン®・F注射液1000・2000「適正使用」に関するお願い
-
販売中止プロスタルモン・F注射液1000 1mL×50A 販売中止のお知らせ
-
適正使用・注意喚起プロスタルモン®・F注射液1000・2000「適正使用」に関するお願い
-
適正使用・注意喚起プロスタルモン®・F注射液1000・2000「適正使用」に関するお願い
-
使用上の注意プロスタルモン®・F注射液1000・2000 使用上の注意改訂のお知らせ
-
適正使用・注意喚起プロスタルモン®・F注射液1000・2000「適正使用」に関するお願い
-
包装・表示プロスタルモン®・F注射液1000(1mL×50A)・2000(2mL×10A) 包装変更のお知らせ
-
包装・表示プロスタルモン®・F注射液1000 1mL×10A 包装変更のお知らせ
-
適正使用・注意喚起プロスタルモン®・F注射液1000・2000「適正使用」に関するお願い
-
適正使用・注意喚起プロスタルモン®・F注射液1000 適正使用に関するお願い
-
適正使用・注意喚起プロスタルモン®・F注射液1000・2000「適正使用」に関するお願い
-
適正使用・注意喚起プロスタルモン®・F注射液1000・2000「適正使用」に関するお願い
-
適正使用・注意喚起プロスタルモン®・F注射液1000・2000「適正使用」に関するお願い
-
適正使用・注意喚起プロスタルモン®・F注射液1000・2000「適正使用」に関するお願い
-
使用上の注意プロスタルモン®・F注射液1000・2000 使用上の注意改訂のお知らせ
-
適正使用・注意喚起プロスタルモン®・F注射液1000・2000「適正使用」に関するお願い
-
適正使用・注意喚起プロスタルモン®・F注射液1000・2000「適正使用」に関するお願い
本製品に関するよくあるご質問
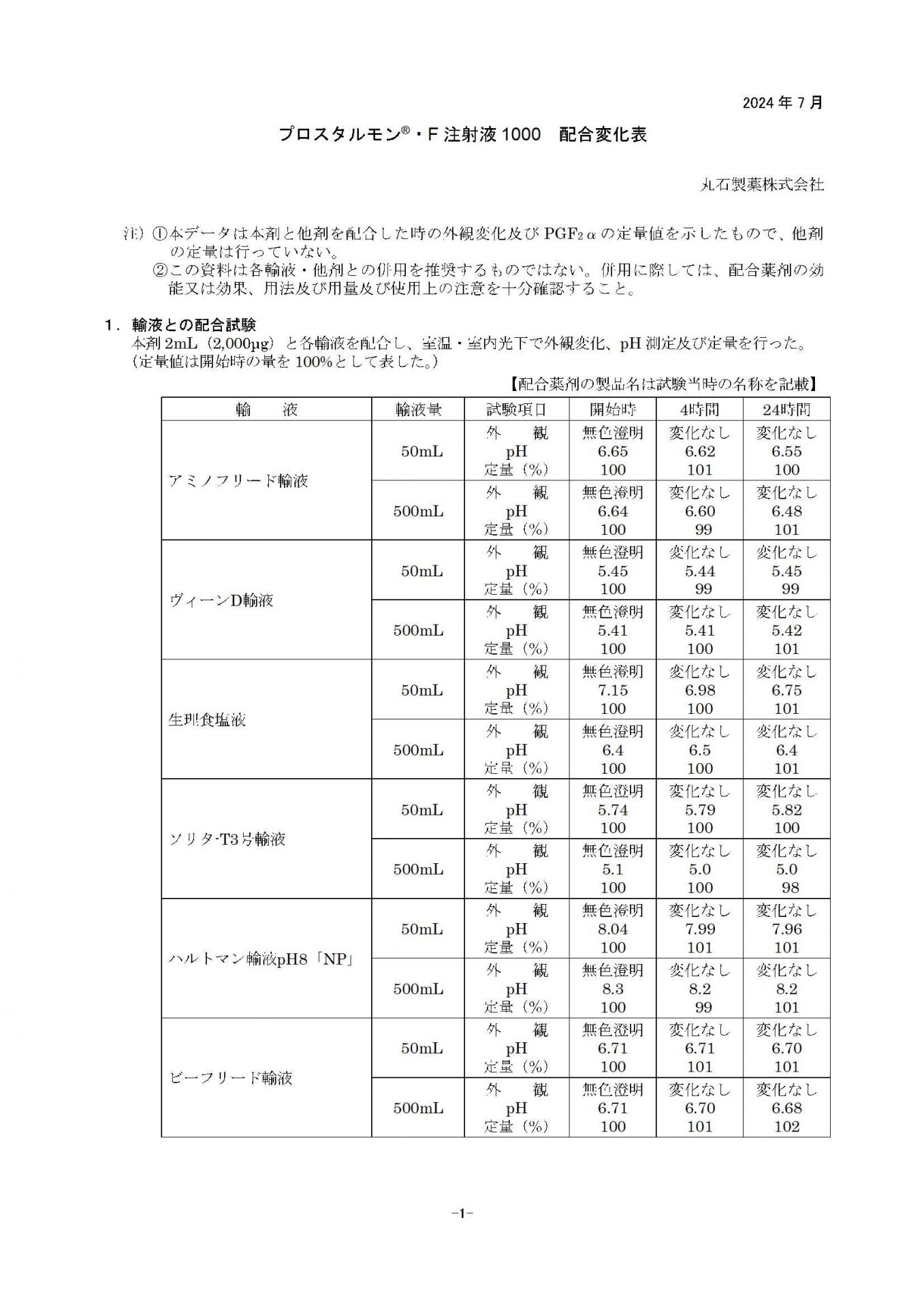
- 配合変化表はありますか?
ございます。こちら
からダウンロードしていただけます。
- 輸液量を減らして使用できますか?
本剤は刺激性に問題がない1)ため、輸液量を減らすことは可能ですが、投与速度を正確に調節できる輸液量で使用してください。
参考文献
1)インタビューフォーム:Ⅸ.非臨床試験に関する項目 2.毒性試験
- 輸液フィルターは使用できますか?
本剤は微量含有製剤であり、持続静脈内投与を行うため、特殊な性能を持つフィルター(エンドトキシン除去性能を持つフィルター)を使用すると吸着することがあります。
なお、フィルター通過性試験試験は行っており、本剤のインタビューフォームに掲載しております。
詳細はインタビューフォームをご覧ください。参考資料
インタビューフォーム:Ⅳ.製剤に関する項目 12. その他
- (腸管蠕動亢進での使用)効果の判定に必要な期間は?
3日間です。
3日間投与しても効果が認められない場合は直ちに投与を中止し、他の治療に切り替えてください。電子添文に以下の記載があります。
6.用法及び用量
<腸管蠕動亢進>
(3)3日間投与しても効果が認められないときは直ちに投与を中止し他の療法にきりかえる。参考資料
電子添文 6.用法及び用量
- 喘息患者に使用しても良いか?
気管支喘息又はその既往歴のある患者への使用は禁忌です。
本剤は気管支平滑筋の収縮作用を有しています。気管支喘息のように既に気道が狭くなっている患者には、PGF2αの投与により更に肺抵抗が上昇し1)、症状が悪化する可能性があります。電子添文には以下の通り記載があります。2)
2.禁忌
<効能効果共通>
2.2 気管支喘息又はその既往歴のある患者〔気管支を収縮させ気道抵抗を増加し、喘息発作を悪化又は誘発するおそれがある。〕8.重要な基本的注意
8.1 心室細動、心停止、ショック、気管支収縮があらわれることがあるので、投与中は循環・呼吸器に対する観察を行い、異常が認められた場合には投与を中止し、適切な処置を行うこと。11.副作用
次の副作用があらわれることがあるので、観察を十分に行 い、異常が認められた場合には投与を中止するなど適切な 処置を行うこと。
11.1 重大な副作用
11.1.2 呼吸困難
喘鳴、呼吸困難等があらわれることがある。参考文献
1)SMITH A.P.:Clinical Science 1973;44:17-25.【PGF0730001 】
2)電子添文:2.禁忌、8.重要な基本的注意、11.副作用
お役立ちツール
各コンテンツ(動画・PDFなど)は、ダウンロードしてお使いいただけます。また、各資材は本サイトから発注できます。
一部ポスターを除き、編集・改変などはご遠慮ください。一部コンテンツは、medパスでのログインまたは新規登録が必要です。
プロスタルモン®・F注射液1000 配合変化表
(2024年07月16日)
プロスタルモン・F注射液1000 患者向医薬ガイド(2024年7月作成)
(2024年07月16日)
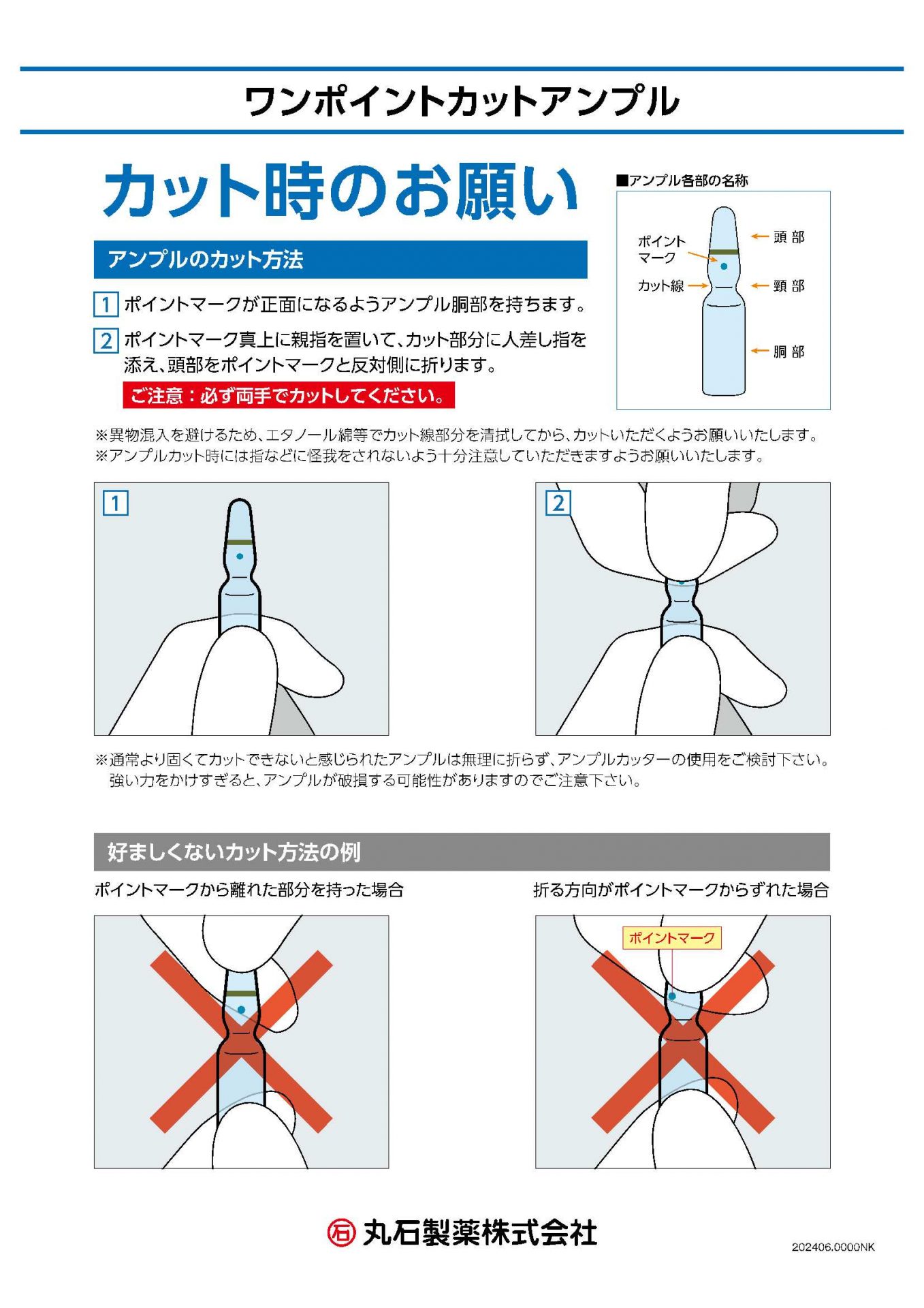
ワンポイントカットアンプル ーカット時のお願いー
(2024年06月03日)
資材をカートへ入れました。