消毒NAVI
オーバーテーブル

オーバーテーブルの消毒方法
オーバーテーブルは頻回に手指が触れる箇所であり、1日1回などの定期的な消毒が必要である。
オーバーテーブルの消毒には汚れの除去効果が期待でき、細菌のみならずウイルスにも有効なアルコール清拭が適している。
消毒用エタノール含浸ワイプやアルコール・界面活性剤含浸ワイプなどを用いる。
また、0.02%(200ppm)~0.05%(500ppm)次亜塩素酸ナトリウム清拭も適している。
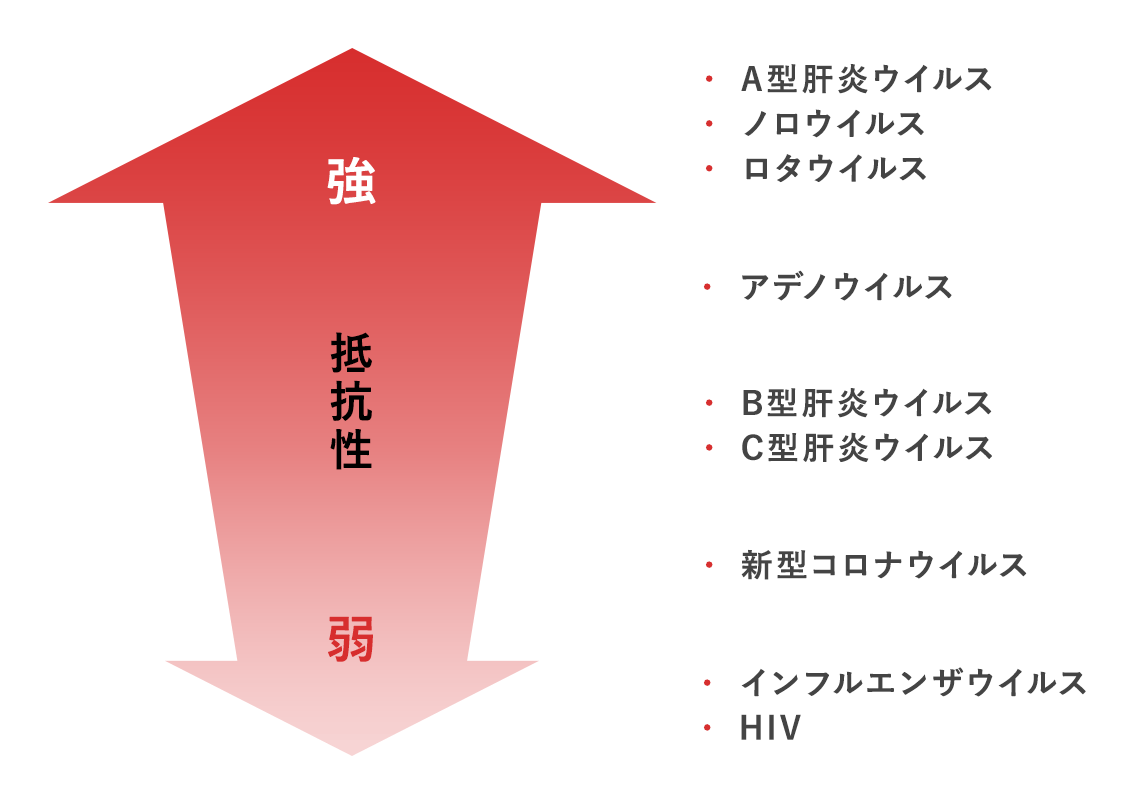
ただし、ノロウイルスやロタウイルスなど消毒薬抵抗性が強いウイルスや(図1)、新型コロナウイルスなどの重要なウイルスが対象となる場合には0.05%(500ppm)~0.1%(1,000ppm)濃度液の使用が望ましい1-8)。
なお、次亜塩素酸ナトリウムによる清拭では、ペーパータオルよりもむしろレーヨンなどの不織布に含浸させて用いるのが望ましい。
次亜塩素酸ナトリウムはペーパータオルなどの紙により効力低下が生じるからである(表1)。
この他、MRSAなどの細菌やカンジダなどの酵母様真菌のみを対象とする場合には、ベンザルコニウム塩化物などの低水準消毒薬含浸ワイプの使用でも差し支えない。
| 材質 | 0.1%(1,000ppm) 次亜塩素酸 ナトリウムの用量(mL) |
残存率(%) |
|---|---|---|
| ペーパータオル (白色、パルプ100%)*2 |
40 | 63.1 |
| 20 | 52.6 | |
| ペーパータオル (茶褐色、パルプ100%)*3 |
40 | 36.8 |
| 20 | 15.8 | |
| 不織布(コットン100%)*4 | 40 | 84.1 |
| 不織布(レーヨン100%)*5 | 40 | 100 |
- *10.1%(1,000ppm)次亜塩素酸ナトリウムを5gのペーパータオルや不織布に含浸させて、約1分間経過後にしぼり液中の次亜塩素酸ナトリウム濃度を調べた.
- *2クリネックスハンドタオル(日本製紙クレシアK.K.,東京)
- *3エリエール超吸収キッチンタオル(大王製紙K.K.,東京)
- *4不織布(川本産業K.K.,大阪)
- *5ネオガーゼ(川本産業K.K.,大阪)
参考資料
- 1) Tan Y-M, et al: Management of inpatients exposed to an outbreak of severe acute respiratory syndrome (SARS). J Hosp Infect. 58: 210-215, 2004
- 2) Tyler R, et al: Virucidal activity of disinfectants: studies with the poliovirus. J Hosp Infect. 15: 339-345, 1990
- 3) CDC: Disaster Safety: Infection control recommendations for prevention of transmission of diarrheal diseases in evacuation centers. September 10, 2005
- 4) Jimenez L, et al: Virucidal activity of a quaternary ammonium compound disinfectant against feline calicivirus: a surrogate for norovirus. Am J Infect Control. 34: 269-273, 2006
- 5) Tung G, et al: Efficacy of commonly used disinfectants for inactivation of human noroviruses and their surrogates. J Food Prot. 76: 1210-1217, 2013
- 6) Sattar SA: Microbicides and the environmental control of nosocomial viral infections. J Hosp Infect. 56: S64-S69, 2004
- 7) Vonberg RP, et al: Infection control measures to limit the spread ofClostridium difficile. Clin Microbiol Infect.14: 2-20, 2008
- 8) Kampf G, et al: Persistence of coronaviruses on inanimate surfaces and their inactivation with biocidal agents. J Hosp Infect. 104: 246-251, 2020
