ディフィシル菌(Clostridioides difficile)
■細菌学的特徴
異星人系の代表格です。異星人である理由は序章の「菌をキャラクターで理解する」をお読みくださいというところですが、もう一度説明しておきましょう。ガホーケイ星からやってきたガホーケイ星人です。ガホーケイ星=芽胞形成・・・。気を取り直してまいりましょう。
異星人系の中でもディフィシル菌に絞ってお話ししますが、その前に、芽胞形成菌について一通り説明しておきます。
臨床的にはクロストリジウム属とバチルス属が重要で、いずれもグラム陽性桿菌に分類されます。なお、ディフィシル菌は、かつて、Clostridium属に分類されていましたが、他のClostridium属菌とは系統的に異なることが指摘され、正式名称は、Clostridioides difficileに変更されました。
芽胞というのは、ただの「芽」ではなく、耐熱構造となっており、100℃までは耐えることができます。高圧蒸気滅菌(オートクレーブ)の2気圧、121℃という条件は、芽胞形成菌の滅菌を目的として作られたものです。熱だけではなく、アルコールなどの一部の消毒薬に抵抗性を示すという点も厄介なところです。ディフィシル菌の消毒に次亜塩素酸ナトリウムが用いられるのはそのような理由によるものです。高温や低栄養状態など、厳しい生息環境に追い込まれたときに芽胞を形成します。芽胞は非常に丈夫な殻で、芽胞の中に自分の重要なパーツを収納します。芽胞の状態では増殖できませんが、長期にわたって生息し続けることができます。再び環境がよくなると、発芽して増殖する、ということです。
芽胞を形成する以外に、それぞれ特異的な毒素を産生するという特徴もあります。ディフィシル菌の場合には、下痢の原因となるCD毒素A、Bを産生します。迅速診断の抗原としても用いられます。CD毒素A、Bに加え、近年、第三の毒素とも呼ばれるバイナリートキシンを産生する株が注目されています。通常の株よりも病原性が高いことが報告されています。バイナリートキシンを産生する特定の型として、リボタイプ(RT)027やRT078等が知られています。
■臨床的特徴
抗菌薬投与中の菌交代症として起こる抗菌薬関連下痢症や偽膜性腸炎などのディフィシル菌関連下痢症(C. difficileassociated diarrhea, CDAD)を起こします。ディフィシル菌は、健常な人の腸内にも生息していると考えられています。しかしながら、健常な腸内では、先住民である大腸菌やバクテロイデス等の腸内細菌が本菌の増殖を抑制していますので症状を呈しません。しかし、抗菌薬の投与によって、先住民が死滅すると、本菌が異常増殖し、CD毒素を産生するため、下痢を引き起こします(図1A-C)。CD毒素A、Bには、大腸粘膜の細胞を傷害する作用があり、下痢はむしろ菌を排出するための正常な反応とも言えます。偽膜性腸炎の偽膜は、大腸を内視鏡で観察したときにみられる膜状構造物で、菌や白血球、剥がれ落ちた粘膜細胞で構成されています。容易に剥がれ、本物の膜ではないという意味で「偽膜」と呼ばれます。

町民である大腸菌やバクテロイデスたちのお陰でディフィシル菌は暴れずに細々と過ごしていました。

町民である大腸菌やバクテロイデスなどが死滅します。
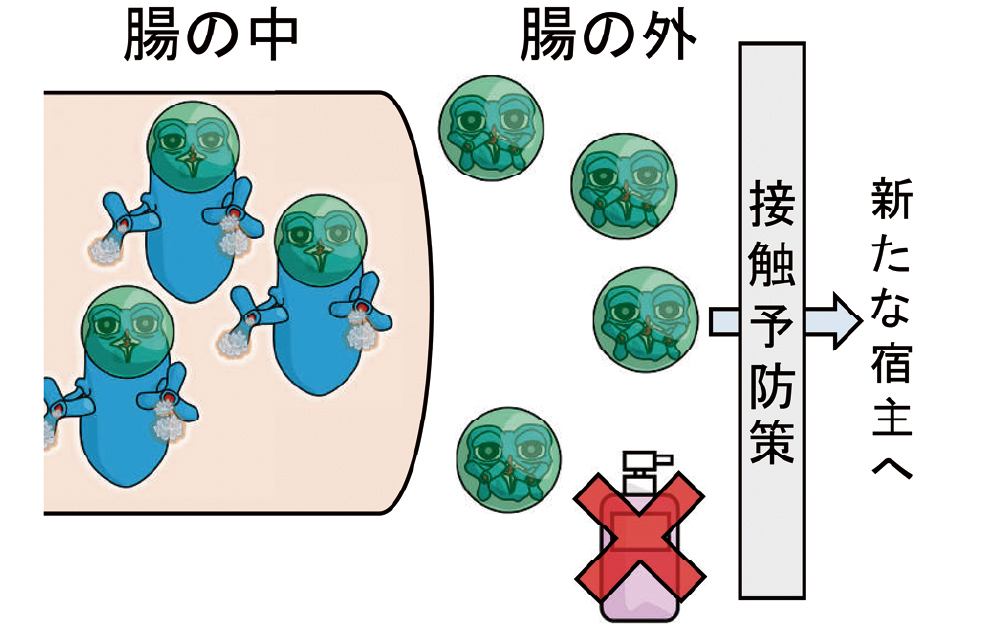
ディフィシル菌が増加しCD毒素を産生し始め、下痢を起こします。
下痢で外に出ると、芽胞を形成し、アルコール消毒が効かない状態となります。こうして新たな宿主を探して旅に出ます。アルコール消毒が効かないため、それ以外の接触予防策が重要になります。
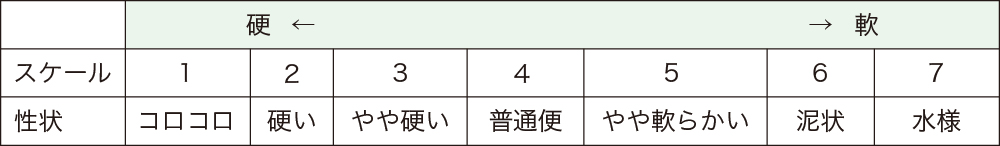
診断には、便中のCD毒素の検出、もしくはCD毒素を産生するディフィシル菌の分離によります。なお、CD毒素を産生しないディフィシル菌もいるため、ディフィシル菌を検出したのみでは、診断できません。便中のCD毒素が検出できなかった場合には、分離した菌からのCD毒素の産生を確認することが重要です。また、ディフィシル菌が有する抗原(GDH)を検出する方法もありますが、毒素産生の有無はわからないため、GDHのみ陽性の場合の解釈には注意が必要です。また、CD毒素が陽性であっても、下痢などの症状がなければ治療の対象とはなりません。便の性状としてブリストル便形状スケールが用いられます(表1)。ブリストル便形状スケール5以上であることが重要です。
感染予防策として、下痢症状が続いている間は、接触予防策が必要です。CD毒素が検出されても、下痢がない場合には原則として接触予防策を解除し、標準予防策のみとします。
■治療
第一選択はメトロニダゾールで、第二選択はバンコマイシン経口投与です。バンコマイシンは内服してもほとんど吸収されないので、腎毒性などの副作用はほとんど出ません。メトロニダゾールは点滴でも使用可能です。無症候性保菌者には原則として治療を行いません。もう一つの選択肢として、2018年に承認されたフィダキソマイシンがあり、難治例や再発例で使用されます。重症や反復性のCDADに対しては、CD毒素Bに対するモノクローナル抗体(ベズロトクスマブ)も利用可能です。
- 1. 金子幸弘. 染方史郎の楽しく覚えず好きになる 感じる細菌学×抗菌薬(じほう)
- 2. Antimicrobial Resistance:Tackling a crisis for health and wealth of nations. UK, December 2014.
- 3. Dancer SJ. Importance of the environment in meticillin-resistantStaphylococcus aureusacquisition:the case for hospital cleaning. Lancet Infect Dis 2008. 8(2):101-13.
- 4. Munoz-Price LS et al. Acinetobacter infection. N Engl J Med 2008. 358(12):1271-81.
- 5. Weber DJ et al. Role of hospital surfaces in the transmission of emerging health care-associated pathogens:norovirus,Clostridium difficile, andAcinetobacterspecies. Am J Infect Control 2010. 38(5 Suppl.1):S25-S33.
- 6. Boyce JM. Environmental contamination makes an important contribution to hospital infection. J Hosp Infect 2007. 65(Suppl.2):50-4.
- 7. Markogiannakis A et al. Cross-transmission of multidrug-resistantAcinetobacter baumanniiclonal strains causing episodes of sepsis in a trauma intensive care unit. Infect Control Hosp Epidemiol 2008. 29(5):410-7.
- 8. 佐伯 康匠, 他.【何が同じで、どこが違う?現場向けESBL産生菌・CRE(CPE)対策】Important ESBL産生菌・CRE(CPE)対策のための3大知見 両耐性菌の共通・相違の視点から 定義と分類の最新知見 現場で必須の知識・役立つ知識. 感染対策ICT ジャーナル. 2019. 14(3):189-94.
- 9. 厚生労働省院内感染対策事業サーベイランス. 全体. 検査部門.
https://janis.mhlw.go.jp/report/kensa.html - 10. Bush K. Past and Present Perspectives on β-Lactamases. Antimicrob Agents Chemother. 2018. 62(10):e01076-18.
- 11. Ubukata K et al. Occurrence of a beta-lactaminducible penicillin-binding protein in methicillin-resistantstaphylococci. Antimicrob Agents Chemother. 1985 May;27(5):851-7.
- 12. 肉用牛農場のシガ毒素産生性大腸菌保有状況調査
https://www.maff.go.jp/j/syouan/seisaku/kekka/gyuniku/stec/01.html(2021年7月8日アクセス) - 13. Namikawa H et al. Clinical characteristics of bacteremia caused by hypermucoviscousKlebsiella pneumoniaeat a tertiary hospital. Diagn Microbiol Infect Dis. 2019 Sep;95(1):84-8.
- 14. 厚生労働省. 抗微生物薬適正使用の手引き 第三版
- 15. MRSA感染症の治療ガイドライン作成委員会編. MRSA感染症の治療ガイドライン 改訂版2019.
- 16. Uttley AH et al. Vancomycin-resistant enterococci. Lancet. 1988 Jan 2-9;1(8575-6): 57-8.
- 17. Leclercq R et al. Plasmid-mediated resistance to vancomycin and teicoplanin inEnterococcus faecium. N Engl J Med. 1988 Jul 21;319(3): 157-61.
- 18. Oren A et al. Valid publication of the names of forty-two phyla of prokaryotes. Int J Syst Evol Microbiol. 2021 Oct;71(10).
- 19. Quintiliani R Jr et al. Conjugal transfer of the vancomycin resistance determinantvanBbetween enterococci involves the movement of large genetic elements from chromosome to chromosome. FEMS Microbiol Lett. 1994 Jun 15;119(3):359-63.
- 20. 感染症法に基づくバンコマイシン耐性腸球菌感染症の届出状況、2019年.
https://www.niid.go.jp/niid/ja/vre-m/vre-idwrs/10325-vre-210423.html - 21. 公開情報 2020年1月~12月 年報(全集計対象医療機関) 院内感染対策サーベイランス 検査部門【入院検体】. https://janis.mhlw.go.jp/report/open_report/2020/3/1/ken_Open_Report_202000.pdf
- 22. Saito N et al. Interhospital transmission of vancomycin-resistantEnterococcus faeciumin Aomori, Japan. Antimicrob Resist Infect Control. 2022 Jul 23;11(1):99.
- 23. Fujiya Y et al. Transmission dynamics of a linearvanA-plasmid during a nosocomial multiclonal outbreak of vancomycin-resistant enterococci in a nonendemic area, Japan. Sci Rep. 2021 Jul 20;11(1):14780.
- 24. カルバペネム耐性腸内細菌科細菌感染症. https://www.mhlw.go.jp/bunya/kenkou/kekkaku-kansenshou11/01-05-140912-1.html
- 25. Naas T et al. Beta-Lactamase DataBase(BLDB) ‒ Structure and Function. J Enzyme Inhib Med Chem. 2017, 32(0), 917-9.
- 26. 石井 良和. 基礎・臨床の両面からみた耐性菌の現状と対策 2 基質特異性拡張型β-ラクタマーゼ(ESBL)産生菌. モダンメディア. 2007. 53(4):98-104.
- 27. Knothe H et al. Transferable resistance to cefotaxime, cefoxitin, cefamandole and cefuroxime in clinical isolates ofKlebsiella pneumoniaeandSerratia marcescens. 1983. 11(6): 315-7.
- 28. Jarlier V et al. Extended broad-spectrum beta-lactamases conferring transferable resistance to newer beta-lactam agents inEnterobacteriaceae: hospital prevalence and susceptibility patterns. Rev Infect Dis. 1988. 10(4):867-78.
- 29. Philippon A et al. Extended-spectrum beta-lactamases. Antimicrob Agents Chemother. 1989. 33(8):1131-6.
- 30. Matsumura Y et al. CTX-M-27- and CTX-M-14- producing, ciprofloxacin-resistantEscherichia coliof the H30 subclonal group within ST131 drive a Japanese regional ESBL epidemic. J Antimicrob Chemother. 2015;70(6):1639-49.
- 31. Shimono N, et al. An outbreak ofPseudomonas aeruginosainfections following thoracic surgeries occurring via the contamination of bronchoscopes and an automatic endoscope reprocessor. J Infect Chemother. 2008;14(6): 418-23.
- 32. Araoka H et al. Risk factors for mortality among patients withStenotrophomonas maltophiliabacteremia in Tokyo, Japan, 1996-2009. Eur J Clin Microbiol Infect Dis. 2010 May;29(5):605-8.
- 33. 公益社団法人日本化学療法学会・一般社団法人日本感染症学会.Clostridioides(Clostridium)difficile感染症診療ガイドライン
謝辞
本コンテンツのもととなった感染対策ニュースでは、3年間にわたり、3シーズン計15回の連載をさせていただきました。読者アンケートでは、「認定の勉強に役立った」「ずっと連載してほしい」といった嬉しいコメントをいただき、いつも執筆の励みにしておりました。また、丸石製薬の担当者様とは何度もオンライン会議を開きましたし、当教室の秘書にはいつも最初に原稿に目を通してもらい、丁寧に校正していただきました。こうした関係者の皆様のご支援なくしてはこのコンテンツはなかったと思います。そして、いつも協力をいただいている教室員、コンテンツの掲載や著書が出るたびに一緒に喜んでくれる家族にも、この場を借りて感謝申し上げます。ありがとうございました。


