金子の分類を使い、AMRの観点で菌を分類すると、図1のようになります。皇族系の肺炎球菌やインフルエンザ菌が院内感染で問題となることはまずありません。皇族系は、体外での生存能力が低いためです。院内感染で問題となるAMRとしては、庶民系、モンスター系が主体となります。
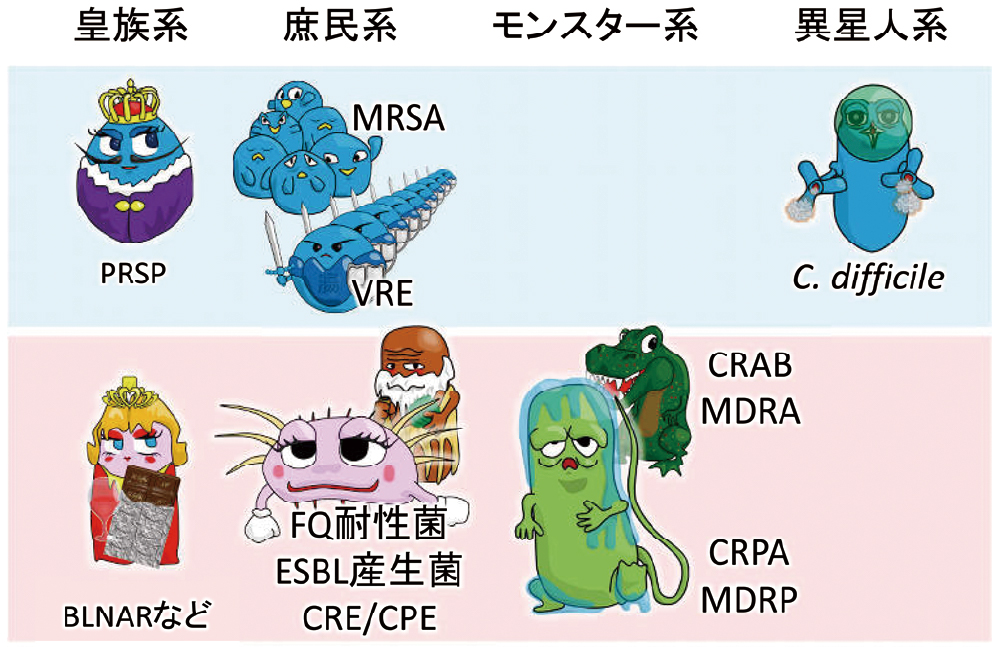
院内感染で問題となるのは、主に庶民系、モンスター系です。
PRSP:ペニシリン耐性肺炎球菌
BLNAR:β-ラクタマーゼ非産生アンピシリン耐性インフルエンザ菌
MRSA:メチシリン耐性黄色ブドウ球菌
VRE:バンコマイシン耐性腸球菌
FQ:フルオロキノロン
ESBL:基質特異性拡張型β-ラクタマーゼ
CRE:カルバペネム耐性腸内細菌目細菌
CPE:カルバペネマーゼ産生腸内細菌目細菌
CRPA:カルバペネム耐性緑膿菌
MDRP:多剤耐性緑膿菌
CRAB:カルバペネム耐性アシネトバクター・バウマニー
MDRA:多剤耐性アシネトバクター
■AMRのサイレントパンデミック
すでにご存知かもしれませんが、2014年に衝撃的な報告が行われました。英国の薬剤耐性に関するレビュー委員会からの報告で、適切な対策を取らない場合、AMRによる年間死亡者数は、2050年には1,000万人に達すると推定されました。インフルエンザやCOVID-19など話題になる感染症流行の水面下で拡大している可能性があり、サイレントパンデミックとして懸念されています。予想が的中するかは、我々の行動にかかっているわけですが、本項では、AMRの現状を理解するための基本的な知識についてご紹介したいと思います。
■抗菌薬は毒なんです
どんな薬でもそうですが、毒と薬は紙一重です。つまり、抗菌薬も毒なんです。ただし、抗菌薬の多くは、ヒトにはほぼ無害で、菌にとって猛毒となります。したがって、菌が生き残るためには、この猛毒に抵抗する必要があります。この抵抗の仕方を耐性機序と呼んでいます。少し独自の表現を使って平たく説明してみましょう。
耐性機序は、①無毒化、②体質の変化、③吐き出す、④そもそも飲まない、の4つに分けられます(図2A)。たとえだけではわかりにくいので、もう少し専門的な用語も補足しておきます(図2B)。
まず、①の無毒化は、薬剤の分解・修飾による薬剤の不活化です。β-ラクタム系薬を分解する「β-ラクタマーゼ」が最も代表的で、最も重要な耐性機序です。②の体質の変化とは、標的の変化です。抗菌薬は、細菌の表面もしくは内部にある「標的」に結合することで効力を発揮します。しかしながら、標的の変化によって、抗菌薬が標的に結合しにくくなると効力が低下します。特に、キノロン系薬の標的であるDNAジャイレースの変異が代表的です。③の吐き出すは文字通りですが、排出ポンプという仕組みを使って、菌体外に薬剤を排出します。いくつかの種類があり、RND型のMexAB-OprMが代表的です。
④のそもそも飲まないというのは、取り込みが低下することです。主にグラム陰性菌の耐性機序で、ポーリンと呼ばれる細菌の「口」を小さくしたり、減らしたりする方法を取っており、OprDというポーリンの関与がよく知られています。ポーリンからはアミノ酸など栄養素も取り入れるので、毒を飲まない代わりに飢餓に耐える必要があります。緑膿菌やアシネトバクターは、元来ポーリンの孔径が小さいために、飢餓に耐えやすい性質を持ち、抗菌薬にも抵抗性を示しやすいと考えられています。
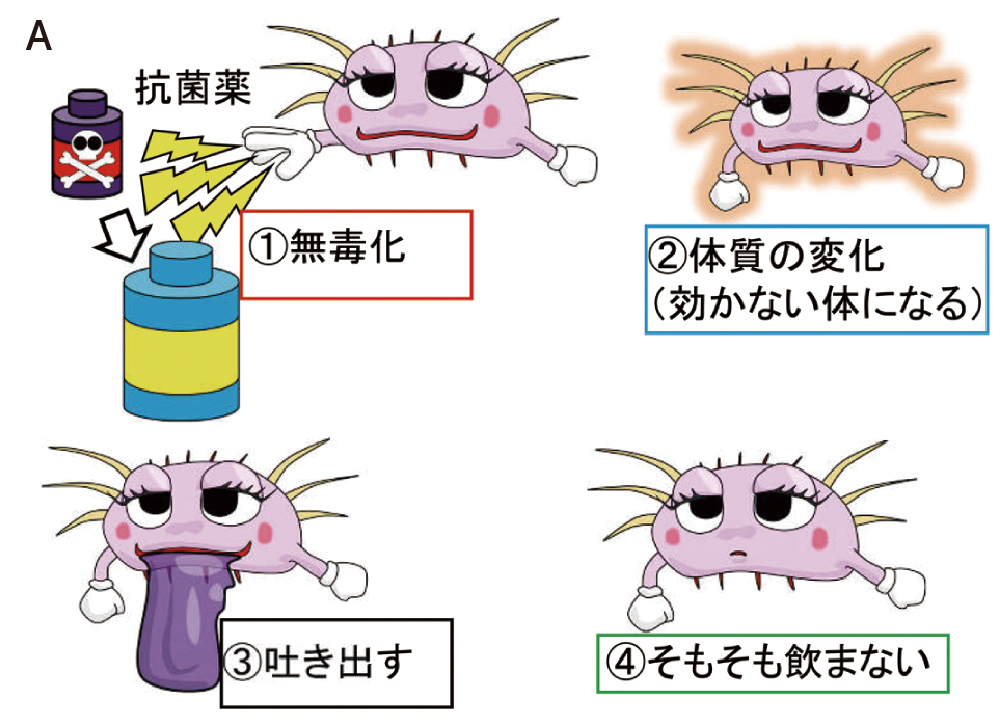
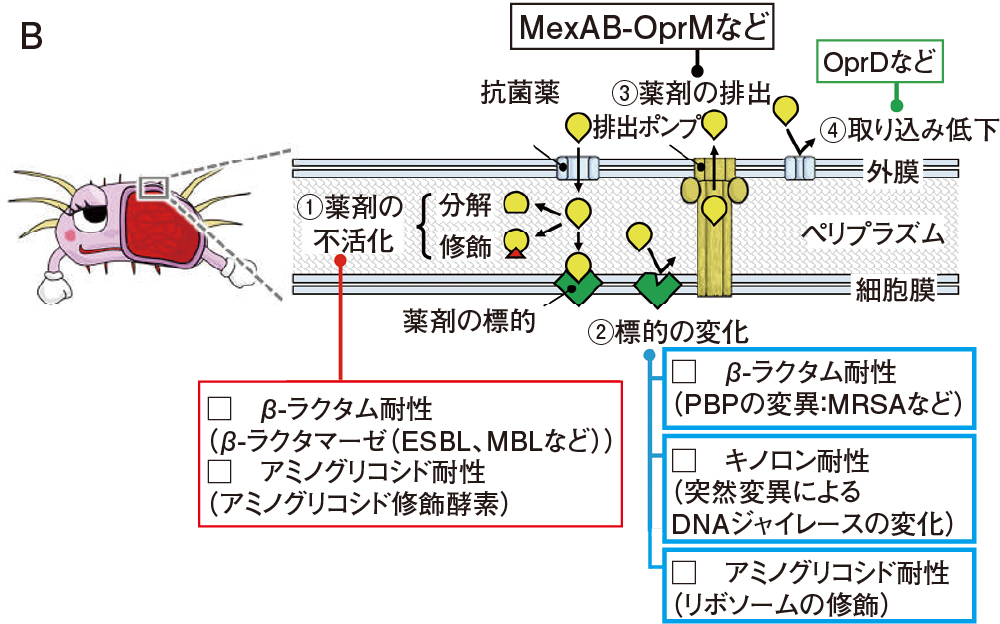
A 感覚的に表現すると、①無毒化、②体質の変化、③吐き出す、④そもそも飲まない
になります。B Aの①~④を専門的に表現すると、①薬剤の不活化、②標的の変化、③薬剤の排出、④取り込みの低下
になります。
■グラム陰性菌はとても慎重です
世界初の天然抗菌薬(=抗生物質)と言えば、皆さんご存知のペニシリンですね。「画期的な治療薬、ペニシリンの登場により、ついに感染症を制圧しました!」と、言いたいところですが、そうは行きませんでした。グラム陽性菌や一部のグラム陰性菌にはよく効きましたが、多くのグラム陰性菌には無効でした。グラム陰性菌はとても慎重なので、栄養素と毒を区別して、できるだけ毒を飲まないようにしています(図3上)。これは、細胞壁の外側にある選択性の高い外膜の存在に加え、排出ポンプが発達しているためです。つまり、そもそも取り込みにくく、取り込んでもすぐに排出してしまうということです。
そこで取り込まれやすいように改良されたのが、アミノペニシリンです。ペニシリンの側鎖にアミノ基という旨み成分をつけることで、大腸菌に飲ませることに成功しました(図3中)。しかしながら、緑膿菌などのモンスター系は、大腸菌よりももっと慎重です。そのため、さらなる改良が行われ、旨み成分倍増のアシルアミノ基がついたピペラシリンという抗緑膿菌作用のあるペニシリンが開発され、見事、緑膿菌に飲ませることにも成功しました(図3下)。
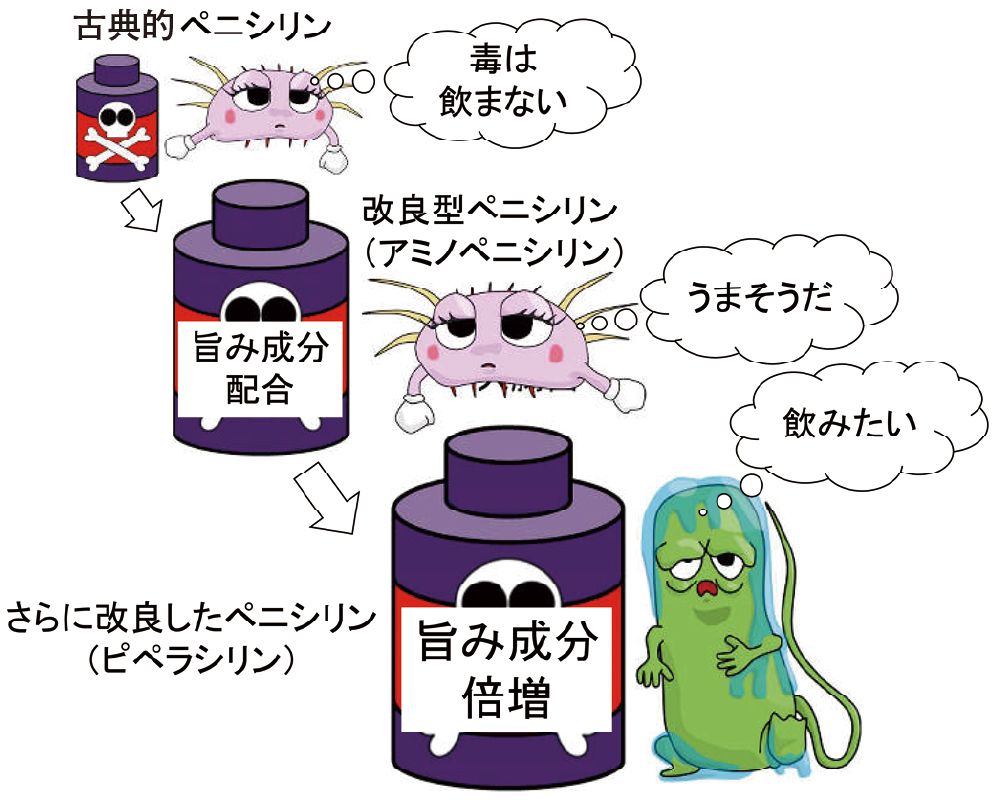
グラム陰性菌は慎重なので、古典的ペニシリンは飲みません。ところが、旨み成分を配合(アミノ基を付加)されると、大腸菌は、騙されて取り込んでしまいます。緑膿菌は、旨み成分を倍増(アミノアシル基を付加)することで、ようやく取り込ませることに成功しました。
抗菌薬は、ペニシリン系薬のみではありません。β-ラクタム系薬として、セフェム系薬やカルバペネム系薬が開発され、スペクトルが格段に広がりました。さらに、キノロン系薬、アミノグリコシド系薬、マクロライド系薬など、β-ラクタム系薬と構造も作用機序も異なる抗菌薬が開発され、今や、100以上の抗菌薬を手に入れました。
その結果どうなったか。タゾバクタム/ピペラシリン、カルバペネム系薬、キノロン系薬といった広域抗菌薬は、守備範囲(スペクトル)をモンスター系まで拡張した抗菌薬です。モンスター系を倒すために開発された、というと少しオーバーかもしれませんが、そういうイメージの抗菌薬です。一方で、モンスターを倒すために、庶民を犠牲にする抗菌薬でもあります。抗菌薬のスペクトルを拡大したために、庶民の怒りを買い、眠れるモンスターを起こす結果となってしまいました。もちろん、抗菌薬の開発のお陰で、様々な感染症と戦えるようになったことは確かですが、AMRという負の産物が新たな問題となりました。
耐性には、一次耐性(自然耐性)と二次耐性(獲得耐性)があり、近年急速に増加しているのは、二次耐性です。一次耐性というのは、古典的ペニシリンが大腸菌に効かないといった、元々持っている耐性です。二次耐性は、元々効いていたはずの抗菌薬に対して、何らかの方法で耐性になってしまった場合です。その「何らかの方法」を「耐性獲得機構」と呼び、大きく2つに分類できます。一つは、鍛えられて強くなる場合(鍛錬型)、もう一つは、耐性アイテムをゲットして強くなる場合(アイテムゲット型)です(図4)。
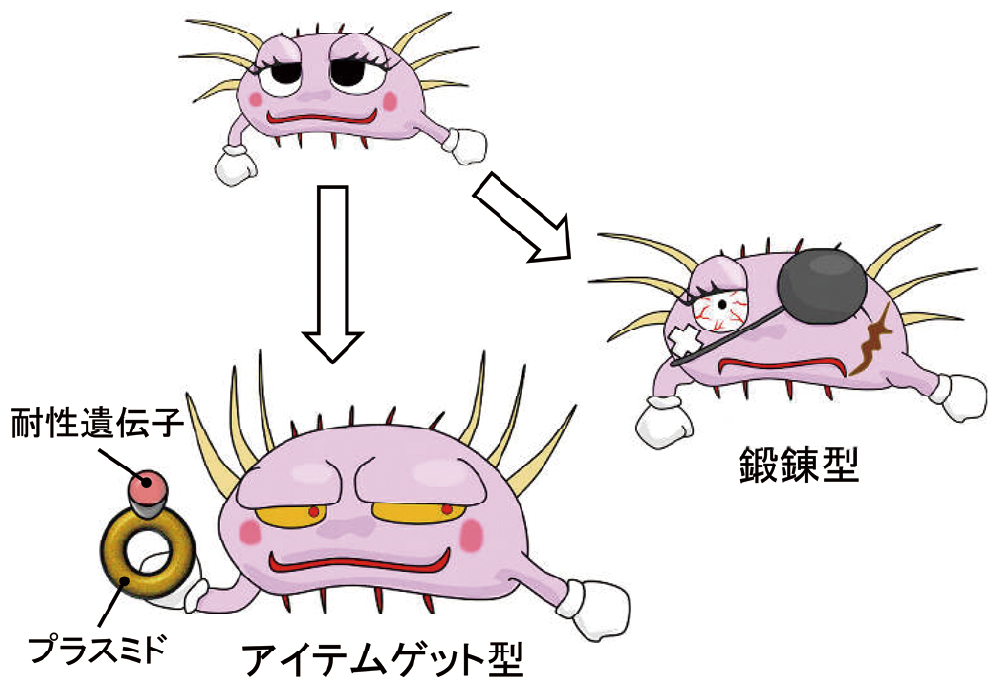
鍛えられて強くなる場合(鍛錬型)とアイテムをゲットして突然強くなる場合(アイテムゲット型)があります。
前者の代表例がフルオロキノロン耐性、後者の代表例がβ-ラクタマーゼによる耐性です。
鍛錬型は、耐性機序の②と関連することが多く、抗菌薬にさらされているうちに、標的をコードする遺伝子が突然変異することによって起こります。代表的なのが、フルオロキノロン耐性で、徐々に耐性がついていきます。
アイテムゲット型は、外部からの耐性遺伝子の獲得で、突然強くなります。ビデオゲームなどで勇者がアイテムをゲットすると急に強くなるイメージです。アイテムの多くは、プラスミドと呼ばれる環状のDNAで、その中に耐性遺伝子が組み込まれています。しかも、このアイテムは、コピーして仲間に渡すことができるのでさらに厄介です。


