筋弛緩回復剤のスガマデクス静注液200mg・500mg「マルイシ」 / スガマデクス静注液200mgシリンジ「マルイシ」をご紹介いたします。
医療関係者の皆さまへ
このウェブサイトは、日本国内の医療関係者(医師、薬剤師、看護師など)を対象に、
医療用医薬品などを適正にご使用いただくための情報を提供しています。
一般の方および日本国外の医療関係者に対する情報提供を目的としたものではありませんのでご了承ください。
医療関係者でない方はこちらからコーポレートサイトをご覧ください。
このウェブサイトは、日本国内の医療関係者(医師、薬剤師、看護師など)を対象に、
医療用医薬品などを適正にご使用いただくための情報を提供しています。
一般の方および日本国外の医療関係者に対する情報提供を目的としたものではありませんのでご了承ください。
医療関係者でない方はこちらからコーポレートサイトをご覧ください。


下にスクロール
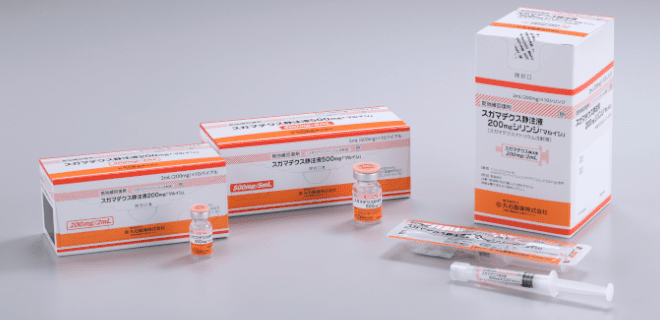
バイアル製剤 (200mg・500mg)
シリンジ製剤 (200mg)


バイアル製剤は
オーソライズドジェネリック
筋弛緩回復剤のスガマデクス静注液200mg・500mg「マルイシ」 / スガマデクス静注液200mgシリンジ「マルイシ」をご紹介いたします。
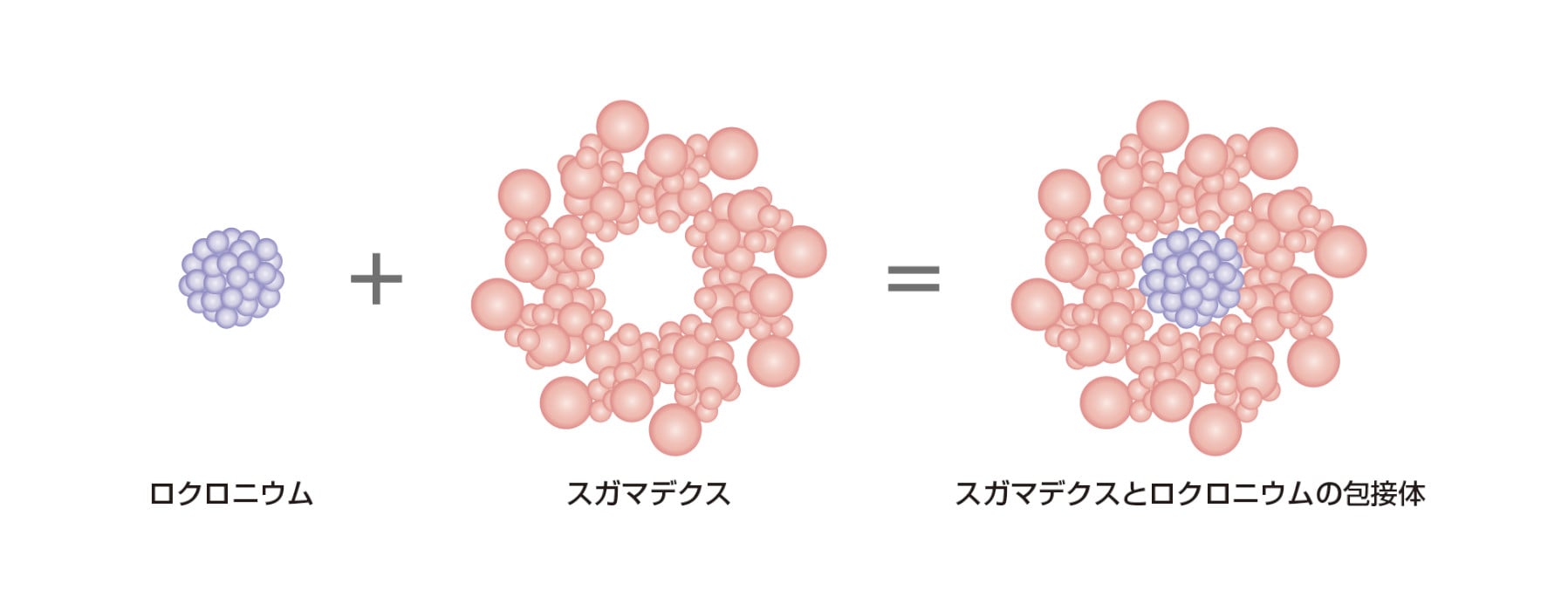
スガマデクスナトリウムはγ-シクロデキストリンの誘導体であり、ステロイド骨格をもつ筋弛緩剤を包接することにより、筋弛緩状態からの回復作用をもつ化合物である。本邦では、「ロクロニウム臭化物又はベクロニウム臭化物による筋弛緩状態からの回復」を効能又は効果として、先発医薬品のブリディオンⓇ静注200mg 及びブリディオンⓇ静注500mg(製造販売元:MSD 株式会社)が2010年1月に承認されています。
丸石製薬株式会社では、後発医薬品としてスガマデクス静注液200mg・500mg「マルイシ」並びにスガマデクス静注液200mgシリンジ「マルイシ」について、製造販売承認を2024年2月15日付で取得しました。
本剤はスガマデクスナトリウム注射液として国内で初めての後発医薬品であり、バイアル製剤(200mg・500mg)はMSD株式会社が製造販売するブリディオンⓇ静注200mg、ブリディオンⓇ静注500mgのオーソライズドジェネリック※として承認を取得しました。
※オーソライズドジェネリック(Authorized Generic)
先発医薬品メーカーより許諾を受けて製造されるジェネリック医薬品
シリンジ製剤(200mg)は、医療現場での利便性を向上させたプレフィルドシリンジ製剤として、先発医薬品と同じ原薬を使用して製造しています。
スガマデクス静注液「マルイシ」は、「ロクロニウム臭化物又はベクロニウム臭化物による筋弛緩状態からの回復」を効能又は効果とする筋弛緩回復剤です。
本剤は筋弛緩剤のロクロニウム臭化物又はベクロニウム臭化物と包接体を形成することにより、神経筋接合部のニコチン受容体と結合可能な筋弛緩剤の濃度を減少させ、筋弛緩状態からの回復が得られます。
重大な副作用として、ショック、アナフィラキシー(いずれも頻度不明)、心室細動、心室頻拍、心停止、高度徐脈(いずれも頻度不明)、冠動脈攣縮(頻度不明)、気管支痙攣(0.3%未満)が報告されています。
主な副作用として、悪心、嘔吐、咳嗽(いずれも 1〜5%未満)が報告されています。
副作用の詳細については電子添文をご参照ください。
誤薬・誤投与防止対策として、「薬剤シリンジラベルに関する提言」※に準じて、筋弛緩拮抗薬のカラーコード「Warm Red と White の対角ストライプ」を用いた包装デザインとしています。
※周術期の誤薬・誤投与防止対策-薬剤シリンジラベルに関する提言-
(公益社団法人日本麻酔科学会 2015年3月27日)
https://anesth.or.jp/files/pdf/guideline_0604.pdf(2024年2月15日確認)

バイアル製剤(200mg・500mg)とシリンジ製剤(200mg)があり、ニーズにあわせた選択が可能です。
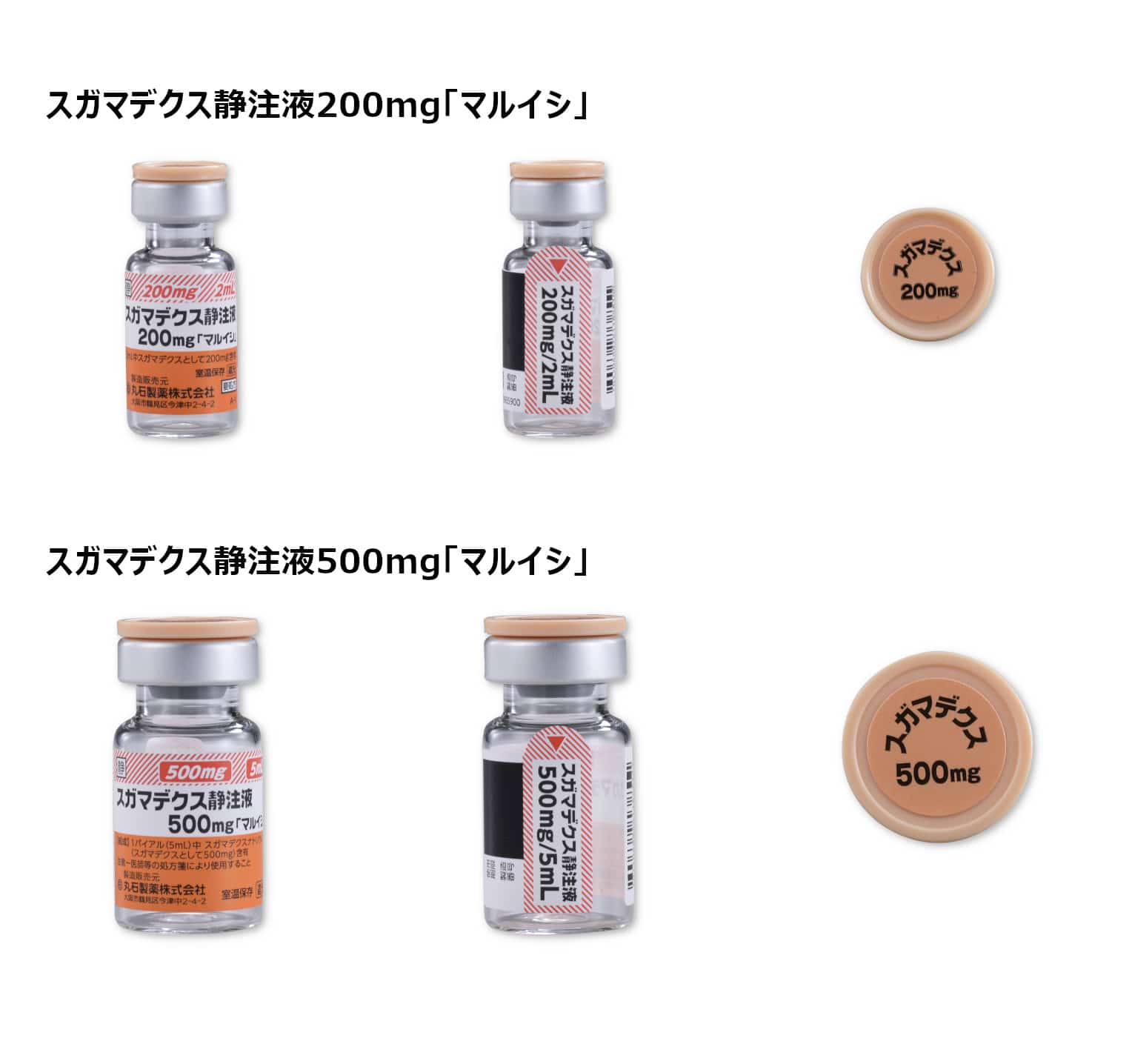
<バイアル製剤の特性>
スガマデクス静注液 200mg・500mg「マルイシ」
オーソライズドジェネリック(AG)※
ブリディオンⓇ静注200mg、ブリディオンⓇ静注500mgのオーソライズドジェネリック(AG)で、先発医薬品と原薬、添加剤、製法、製造場所、容器(バイアル・ゴム栓)が同じです。
※オーソライズドジェネリック(Authorized Generic)
先発医薬品メーカーより許諾を受けて製造されるジェネリック医薬品
副片付きラベル / バイアルキャップ天面表示
筋弛緩拮抗薬のカラーコードを用いた副片付きラベルで、バイアルキャップ天面に有効成分名及び含量を表示しています。
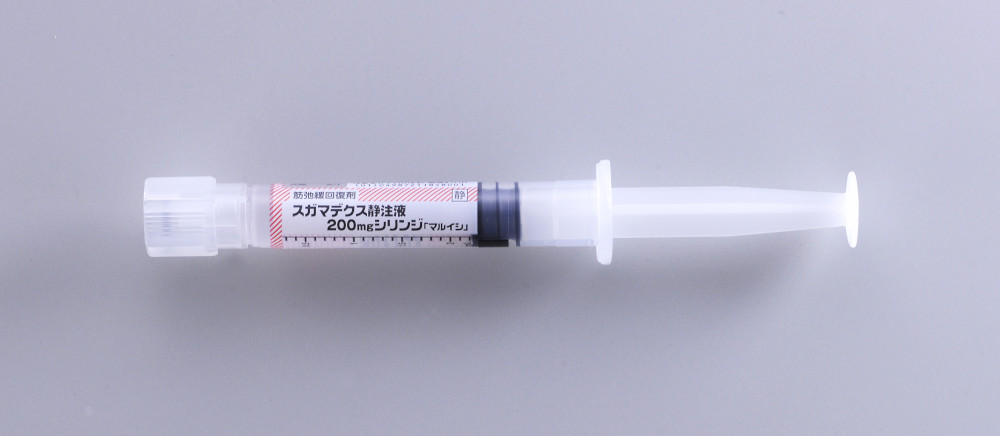
<シリンジ製剤の特性>
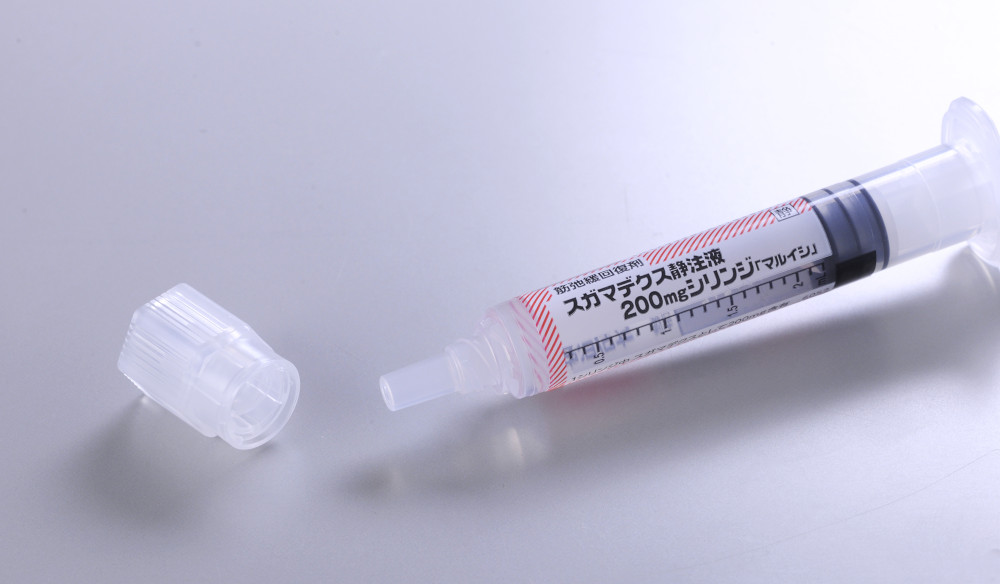
スガマデクス静注液 200mg シリンジ「マルイシ」
原薬
先発医薬品と同じ原薬を使用して製造しています。
プレフィルドシリンジ製剤(充填済みシリンジ剤)
薬液吸引が不要で、微生物汚染や異物混入の軽減が期待できます。
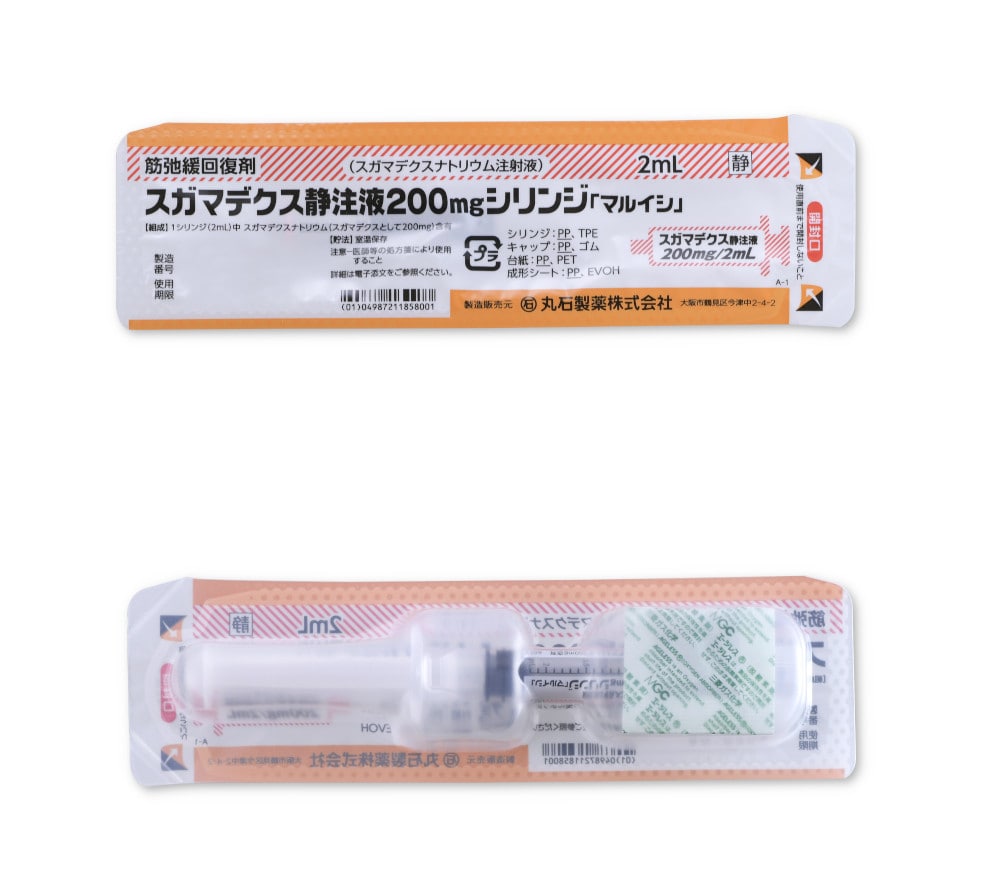
ブリスター包装での安定性
安定性を改善するため、ブリスター包装内に脱酸素剤を封入しています。
オーソライズド・ジェネリック(AG:Authorized Generic)とは何ですか?
一般的には、有効成分のみならず、原薬※、添加物、製法等が先発医薬品と同一で、先発医薬品メーカーより許諾(Authorize)を受けて製造される後発医薬品がオーソライズド・ジェネリック(AG:Authorized Generic)と呼ばれています1)。
AGは以下のパターンに分かれることがあります2)。
AG1:先発医薬品と同じ原薬、添加物、製法、工場、技術を用いて製造
AG2:先発医薬品と同じ原薬、添加物、製法を用いて製造
AG3:先発医薬品と同じ添加物、製法を用いて製造
※ 原薬とは、医薬品の製造に使用されたときに有効成分となるもの3)
1)中央社会保険医療協議会薬価専門部会(第156 回) 中医協 薬-129.8.9
2)東京保険医協会「ジェネリック医薬品」特設ページ
3)平成13年11月2日医薬発第1200号厚生労働省医薬局長通知
前の回答にあるオーソライズド・ジェネリック(AG:Authorized Generic)のパターンのうち、スガマデクス静注液「マルイシ」はいずれに該当しますか?
スガマデクス静注液200mg・500mg「マルイシ」はAG1に該当します。
スガマデクス静注液200mgシリンジ「マルイシ」はAGに該当しません※。
※ シリンジ製剤はAGに該当しませんが、先発医薬品と同じ原薬を使用して製造しています。
スガマデクスの過少投与による危険性はありますか?
スガマデクスの過少投与は筋弛緩の再発(再クラーレ化)の発生の危険性があります。
これは血中で包接できなかったロクロニウムが神経筋接合部に再分布することで発生すると考えられています。
用法及び用量に従った筋弛緩の深さと体重に応じた投与量の設定をお願いいたします。
6. 用法及び用量※
通常、成人にはスガマデクスとして、浅い筋弛緩状態(筋弛緩モニターにおいて四連(TOF)刺激による2回目の収縮反応(T2)の再出現を確認した後)では1回2mg/kgを、深い筋弛緩状態(筋弛緩モニターにおいてポスト・テタニック・カウント(PTC)刺激による1~2回の単収縮反応(1-2PTC)の出現を確認した後)では1回4mg/kgを静脈内投与する。また、ロクロニウム臭化物の挿管用量投与直後に緊急に筋弛緩状態からの回復を必要とする場合、通常、成人にはスガマデクスとして、ロクロニウム臭化物投与3分後を目安に1回16mg/kgを静脈内投与する。
7. 用法及び用量に関連する注意※
7.1 筋弛緩モニターによる確認ができない場合は、十分な自発呼吸の発現を確認した後はスガマデクスとして2mg/kgを投与すること。十分な自発呼吸の発現を確認する前のロクロニウム臭化物による筋弛緩に対してはスガマデクスとして4mg/kgを投与するが、筋弛緩状態からの回復が遅延することがあるため、患者の状態を十分に観察すること。なお、筋弛緩モニターによる確認ができない場合の自発呼吸の発現を確認する前のベクロニウム臭化物による筋弛緩に対する本剤の有効性及び安全性は確立されていない。
7.2 ベクロニウム臭化物の挿管用量投与直後に緊急に筋弛緩状態からの回復を必要とする場合の本剤の有効性及び安全性は確立していない。
8. 重要な基本的注意※
8.4 筋弛緩作用の残存による呼吸抑制、誤嚥等の合併症を防止するため、患者の筋弛緩が十分に回復したことを確認した後に抜管すること。また、抜管後も筋弛緩作用の再発が起きるおそれがあるので患者の観察を十分に行うこと。
※ 電子添文 引用
スガマデクスの重大な副作用はどういったものがありますか?
重大な副作用として以下があります※。
● ショック、アナフィラキシー(いずれも頻度不明)
潮紅、蕁麻疹、紅斑性皮疹、喘鳴、血圧低下、頻脈、舌腫脹、咽頭浮腫等を起こすことがある。
注)外国人健康成人に本剤を非麻酔下で投与したとき、アナフィラキシーを含む過敏反応は16mg/kg投与群で14/148例(9.5%)、4mg/kg投与群で10/151例(6.6%)認められた。
● 心室細動、心室頻拍、心停止、高度徐脈(いずれも頻度不明)
● 冠動脈攣縮(頻度不明)
● 気管支痙攣(0.3%未満)
※ 副作用の詳細については電子添文をご参照ください。
開封後の保存について気をつけることはありますか?
スガマデクス静注液200mg・500mg「マルイシ」の外箱開封後は遮光して保存(遮光袋・遮光箱 等)してください。
スガマデクス静注液200mgシリンジ「マルイシ」のブリスター包装は使用時まで開封せず、開封後は速やかに使用してください。
スガマデクス静注液 200mg シリンジ「マルイシ」はどこで製造していますか?
テルモ株式会社(国内)で製造しています。
筋弛緩薬と拮抗薬について知りたいです。
こちらのページを参考にしてください。






