がん性皮膚潰瘍臭改善薬のメトロニダゾールゲル0.75%「マルイシ」※をご紹介いたします。
※ 本剤の効能又は効果は「がん性皮膚潰瘍部位の殺菌·臭気の軽減」です。
※ 本剤は「酒さ」の効能又は効果を有していません。
このウェブサイトは、日本国内の医療関係者(医師、薬剤師、看護師など)を対象に、
医療用医薬品などを適正にご使用いただくための情報を提供しています。
一般の方および日本国外の医療関係者に対する情報提供を目的としたものではありませんのでご了承ください。
医療関係者でない方はこちらからコーポレートサイトをご覧ください。


下にスクロール

「がん性皮膚潰瘍部位の殺菌・臭気の軽減」の効能又は効果

包装
チューブ:50g×1、100g×1
がん性皮膚潰瘍臭改善薬のメトロニダゾールゲル0.75%「マルイシ」※をご紹介いたします。
※ 本剤の効能又は効果は「がん性皮膚潰瘍部位の殺菌·臭気の軽減」です。
※ 本剤は「酒さ」の効能又は効果を有していません。
がん性皮膚潰瘍臭改善薬メトロニダゾールゲル0.75%「マルイシ」(以下、本剤)は、1g中に日局メトロニダゾールを7.5mg含有する水性ゲル製剤の局所皮膚適用製剤です。
メトロニダゾールは、嫌気性条件下で原虫又は細菌内の酸化還元系によって還元を受け、ニトロソ化合物に変化します。このニトロソ化合物がDNAと結合してDNA合成を阻害し、また、反応途中で生成したヒドロキシルアミン付加体がDNA損傷を惹起して、抗原虫作用及び抗菌作用を示すため1,2)、嫌気性菌感染症等に対する治療薬として、本邦では経口剤、経腟剤、注射剤及び水性ゲル剤3)が承認されています。水性ゲル剤については、2015年に「がん性皮膚潰瘍部位の殺菌·臭気の軽減」の効能又は効果にて上市されています。
丸石製薬株式会社では、ゲル基剤に塩、pH及び水分過多の影響が少なく、保形性が高く、患部へ固着しにくいとされる疎水化ヒドロキシプロピルメチルセルロース4,5)を用いて処方設計を行い、メトロニダゾールの水性ゲル剤の後発医薬品として開発を行いました。
本剤の先発医薬品との生物学的同等性の評価にあたり、有効性については、「局所皮膚適用製剤の後発医薬品のための生物学的同等性試験ガイドライン」6)に基づき、最小発育阻止濃度(Minimum Inhibitory Concentration : MIC)による寒天平板希釈法を用いたin vitro効力試験により生物学的同等性について評価を行いました。一方、安全性については、がん性皮膚潰瘍を有する患者を対象に血漿中薬物濃度及び有害事象を指標として両剤の安全性を比較検討することにより評価を行いました。
今般、in vitro効力試験による生物学的同等性試験及びがん性皮膚潰瘍を有する患者を対象とした安全性確認試験の結果より、本剤は先発医薬品と比較して生物学的に同等であると確認されたことから「がん性皮膚潰瘍部位の殺菌·臭気の軽減」の効能又は効果にて、2023年2月に製造販売承認を取得しました。
1)Freeman C.D., et al.:Drugs 1997; 54(5): 679-708[J0970001]
2)Bendesky A., et al.:Mutat Res. 2002; 511(2): 133-144[J2020001]
3)Paul J.C., et al.:Ostomy Wound Manage. 2008; 54(3): 18-27[J2080001]
4)渡部一宏, 他. 乳癌の臨床 2008; 23(2): 105-109[J2080002]
5)渡部一宏, 他. 日本緩和医療薬学雑誌2009;2:39-43[J2090001]
6)厚生労働省. 薬食審査発第1124004号厚生労働省医薬食品局審査管理課長通知、平成18 年11月24日、別紙4
本剤は1g中に日局メトロニダゾールを7.5mg含有する水性ゲル製剤の後発医薬品です。
本剤の効能又は効果は「がん性皮膚潰瘍部位の殺菌·臭気の軽減」です。※
※本剤は「酒さ」の効能又は効果を有していません。
ゲル基剤に「疎水化ヒドロキシプロピルメチルセルロース」を使用した処方です。

包装
50g・100gチューブがあります。100gチューブは大容量ニーズへ対応しています。
容器の材質は、チューブがアルミニウム及びポリエチレン、キャップがポリプロピレンです。
有効成分のメトロニダゾールは光により黄褐色に変色することから、遮光性の高いアルミニウム・ポリエチレン製ラミネートチューブを容器に採用しています。
キャップはワンタッチ式· ネジ式のどちらでも使用可能です。ワンタッチ式とネジ式で口径が異なるため塗布量により開け方を選べます。

主な副作用として潰瘍部位からの出血、接触皮膚炎、乾燥、そう痒、つっぱり感、皮脂欠乏症等があらわれることがあります。
電子添文の副作用及び臨床成績の安全性の結果をご参照ください。
試験概要
目的
「局所皮膚適用製剤の後発医薬品のための生物学的同等性試験ガイドライン」6)に基づき、メトロニダゾールゲル0.75%「マルイシ」(本剤)及び標準製剤(1g中メトロニダゾール7.5mgを含有するゲル製剤)に対する各種菌株の薬剤感受性測定(MIC測定)を行い、その結果より、両製剤が生物学的に同等であることを判定すること
6)厚生労働省. 薬食審査発第1124004号厚生労働省医薬食品局審査管理課長通知、平成18 年11月24日、別紙4
対象
がん性皮膚潰瘍病巣部からの検出菌及び悪臭の原因菌を踏まえた、Clostridium perfringens、Bacteroides fragilis、Fusobacterium nucleatum、Prevotella melaninogenicaの4菌種
方法
臨床検査標準協会(Clinical and Laboratory Standards Institute: CLSI8,9)) に準じた寒天平板希釈法にて実施した。
試験条件は以下の表のとおりとした。
| 薬剤 | 希釈液 | 測定濃度範囲 | 施行回数 |
|---|---|---|---|
| 本剤 | 滅菌精製水 | 16~0.0075μg/mLの 2倍希釈系列12段階 |
15※ |
| 標準製剤 | 滅菌精製水 |
※ 測定培地作製、前培養から判定までの工程を1施行とし、15施行(n=15)測定した。
8)Performance standards for antimicrobial susceptibility testing (CLSI M100, 30th edition, 2020)
9)Methods for antimicrobial susceptibility testing of anaerobic bacteria (CLSI M11, 9th edition, 2018)
評価項目
MIC range及びMIC最頻値
生物学的同等性の判定
本剤のMICの最頻値及びそのばらつきが、標準製剤のMICの最頻値±1管差以内に収まる場合、生物学的に同等であると判定した。
病巣部検出菌及び臭気の原因菌に対するメトロニダゾールの感受性
本剤と標準製剤について、がん性皮膚潰瘍病巣部からの検出菌及び潰瘍部位における臭気の原因菌となる菌種を対象にin vitro試験として最小発育阻止濃度(MIC)を測定した。その結果、両製剤のMICは同等であり生物学的同等性が確認された。
各種試験菌株に対するメトロニダゾールの感受性
| 試験菌株 | 測定薬剤 | MIC range(μg/mL) | 最頻値(μg/mL) |
|---|---|---|---|
| グラム陽性嫌気性菌 | |||
| Clostridium perfringens ATCC 13124 |
本剤 | 0.5-1 | 1 |
| 標準製剤 | 0.5-1 | 1 | |
| グラム陰性嫌気性菌 | |||
| Bacteroides fragilis ATCC 25285 |
本剤 | 0.5-1 | 0.5 |
| 標準製剤 | 0.5-1 | 0.5 | |
| Fusobacterium nucleatum ATCC 25586 |
本剤 | 0.015-0.03 | 0.03 |
| 標準製剤 | 0.015-0.03 | 0.03 | |
| Prevotella melaninogenica ATCC 25845 |
本剤 | 0.5-1 | 0.5 |
| 標準製剤 | 0.5-1 | 0.5 | |
判定基準:本剤のMICの最頻値及びばらつきが、標準製剤のMICの最頻値±1管差以内
メトロニダゾールゲル0.75%「マルイシ」電子添文
6.用法及び用量
症状及び病巣の広さに応じて適量を使用する。潰瘍面を清拭後、1日1~2回ガーゼ等にのばして貼付するか、患部に直接塗布しその上をガーゼ等で保護する。
試験概要
目的
がん性皮膚潰瘍患者を対象に、血中薬物濃度及び有害事象を指標としてメトロニダゾールゲル0.75%「マルイシ」(本剤)と標準製剤(1g中メトロニダゾール7.5mgを含有するゲル製剤)の安全性を比較検討する。
試験デザイン
多施設共同、非盲検試験
対象
がん性皮膚潰瘍に対して標準製剤を使用している患者
・薬物動態解析対象集団 17例
・安全性解析対象集団 20例
主な選択基準
〔スクリーニング(Day -7)における選択基準〕
1. 同意取得時の年齢が20歳以上の患者(性別不問、入院/外来の別は問わない)
2. がん性皮膚潰瘍を有する患者
3. 被験部位の潰瘍面積が、1日の投与量として30gまでの大きさ(通常、10gあたり200cm2)の患者(乳がん患者の場合は、一側の乳房の大きさを超えないこと)
4. 標準製剤を7日以上継続して使用している患者
5. スクリーニング以降も継続して治験薬を使用できる者
6. 1ヵ月以上の生存が見込まれる者
7. 治験実施計画書の規定、特に来院予定、併用禁止薬、治験薬投与に関して従うことのできる者
8. 本治験の参加に患者本人から文書による同意が得られた日本人患者(二親等以内の親族がすべて日本人)
〔Day 0における選択基準〕
1. 標準製剤をDay 0当日に塗布せずに来院した者(外来患者の場合)
2. Day -6~-1の間、標準製剤を1日1~2回、一定の投与量で継続して使用した者
3. 潰瘍面積がスクリーニング時から大きく変わっていない者
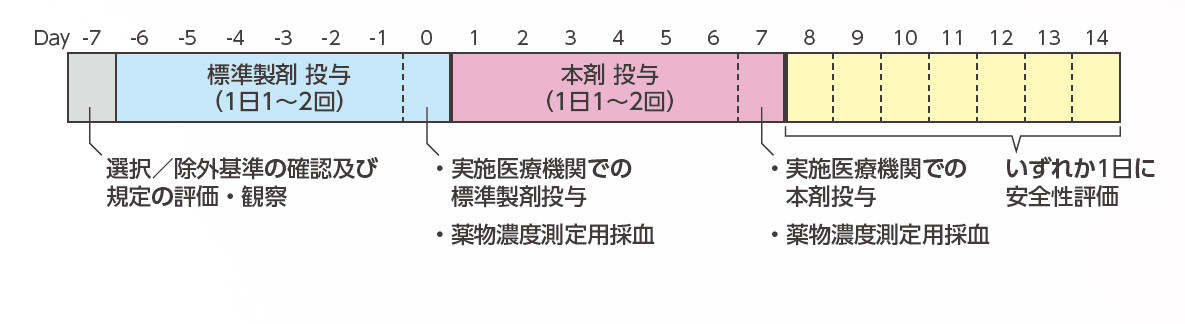
方法
患者本人から同意取得後、Day -7に選択/除外基準の確認及び規定の評価·観察を行った。Day -6~0は標準製剤投与期間とし、1日1~2回、一定の投与量で投与した。なお、Day 0は、実施医療機関にて標準製剤を投与し、投与後2±0.5、4±0.5、6±0.5時間に薬物濃度測定用採血を行った。Day 1~7は本剤投与期間とし、Day -6~0と同様に1日1~2回、一定の投与量で投与した。なお、Day 7は、実施医療機関にて本剤を投与し、投与後2±0.5、4±0.5、6±0.5時間に薬物濃度測定用採血を行った。Day 8~14の間の1日にフォローアップを行い、安全性の評価を行った。
評価項目
1) 薬物動態学的評価
(1) 血漿中メトロニダゾール濃度
採血ポイント:Day 0及びDay 7の治験薬投与後2±0.5、4±0.5、6±0.5時間
(2) 薬物動態パラメータ
Day 0及びDay 7:最高血漿中濃度(Cmax)、最高血漿中濃度到達時間(Tmax)
2) 安全性評価
(1) 有害事象
(2) 臨床検査(血液学的検査、血液生化学的検査)
(3) バイタルサイン(収縮期/拡張期血圧、脈拍数)
(4) 身体所見
3) その他の評価
(1) においの評価:医療従事者を対象としたにおいの評価
(2) 使用感評価
解析計画
1) 人口統計学的データ及びその他のベースラインの特性
人口統計学的データ及びその他のベースラインの特性を、連続変数については記述統計量を用いて要約し、分類変数は該当例数及びその割合を算出した。
2) 薬物動態の解析
測定された薬物濃度及び算出された薬物動態パラメータ(Day 0及び7:Cmax、Tmax)について、記述統計量を用いて要約した。
個々の患者のCmax について、Day 0(標準製剤)に対するDay 7(本剤)の比を算出し、記述統計量を用いて要約した。
3) 安全性の解析
有害事象は試験治療下における有害事象(TEAE)とすることとし、ICH国際医薬用語集日本語版(MedDRA/J)Ver.24.0にてコーディングした。有害事象名は器官別大分類(SOC)及び基本語(PT)ごとに分類し、発現頻度を投与群ごとに集計した。重篤な有害事象は詳細を記述した。
各時点の臨床検査値は、記述統計量を用いて要約した。また本剤投与前後の基準値未満、基準値内、基準値超のシフトテーブルを作成した。
バイタルサインは、測定値及び本剤投与前からの変化量について記述統計量を用いて要約した。
身体所見は、各時点の正常/異常について該当例数及びその割合を算出した。
4) その他の解析
においの評価の解析は、におい評価のスコアを、記述統計量を用いて要約した。また、各スコアの頻度を集計した。標準製剤と本剤のスコアについて、Wilcoxon signed rank testを行った。
使用感評価の解析は、各項目におけるスコアを、記述統計量を用いて要約した。また、各スコアの頻度を集計した。標準製剤と本剤のスコアについて、Wilcoxon signed rank testを行った。
1) 薬物動態学的評価 【薬物動態解析対象集団】
患者背景(人口統計学的データ及びその他のベースラインの特性)
患者は全例が女性であり、年齢(平均値±標準偏差、以下同じ)は64.1±13.9歳、身長は153.94±6.24 cm、体重は57.96±12.15 kgであった。がんのステージはⅢが3例(15.0%)、Ⅳが17例(85.0%)であった。がんの種類(部位)及び皮膚潰瘍の部位は、全例が乳がん及び乳房であり、皮膚潰瘍の面積は、スクリーニング時で47.4±48.6 cm2、Day 0で49.1±48.7 cm2であった。1日あたりの使用回数は標準製剤、本剤ともに1.3±0.5回であり、総使用回数は標準製剤で9.8±4.0回、本剤で9.6±3.5回、1回あたりの使用量は標準製剤で8.1±6.1g、本剤で7.2±6.0g、総使用量は標準製剤で76.1±59.2g、本剤で63.1±49.3gであった。ドレッシング材の種類は、創傷被覆・保護材が12例(60.0%)、ガーゼ及びその他が各4例(20.0%)であった。
| 性別 | 全例 女性 | |
| 年齢※ | 64.1±13.9 歳 | |
| 身長※ | 153.94±6.24 cm | |
| 体重※ | 57.96±12.15 kg | |
| がんのステージ | Ⅲ | 3例(15.0%) |
| Ⅳ | 17例(85.0%) | |
| がんの種類(部位) | 全例 乳がん | |
| 皮膚潰瘍の部位 | 全例 乳房 | |
| 皮膚潰瘍の面積※ | スクリーニング時 | 47.4±48.6 cm2 |
| Day 0 | 49.1±48.7 cm2 | |
| 1日あたりの使用回数※ | 標準製剤 | 1.3±0.5 回 |
| 本剤 | 1.3±0.5 回 | |
| 総使用回数※ | 標準製剤 | 9.8±4.0 回 |
| 本剤 | 9.6±3.5 回 | |
| 1回あたりの使用量※ | 標準製剤 | 8.1±6.1 g |
| 本剤 | 7.2±6.0 g | |
| 総使用量※ | 標準製剤 | 76.1±59.2 g |
| 本剤 | 63.1±49.3 g | |
| ドレッシング材の種類 | 創傷被覆・保護材 | 12例(60.0%) |
| ガーゼ | 4例(20.0%) | |
| その他 | 4例(20.0%) | |
※平均値±標準偏差
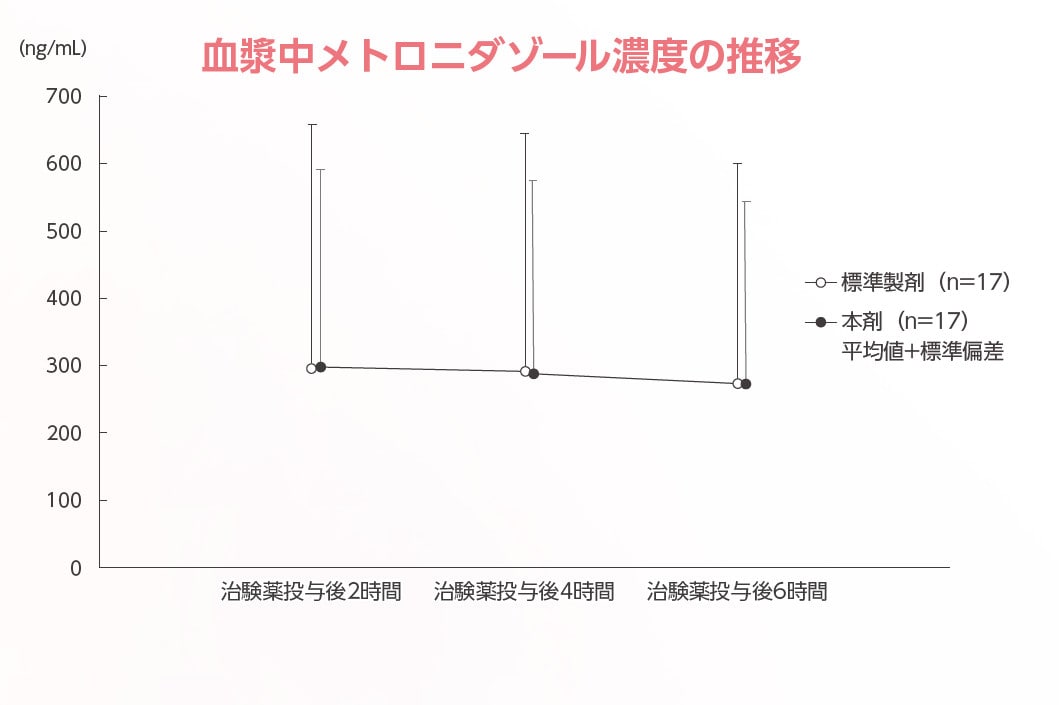
血漿中メトロニダゾール濃度推移
標準製剤または本剤を7日間投与した後の血漿中メトロニダゾール濃度推移は、以下の図のとおりであった。
薬物動態パラメータ
平均最高血漿中濃度は、標準製剤で303.650 ng/mL(範囲:5.881~1112.000 ng/mL)、本剤で305.078 ng/mL(範囲:5.175~871.000 ng/mL)であった。
また、最高血漿中濃度到達時間(中央値)は標準製剤で4.0時間、本剤で2.0時間であったが、投与2、4、6時間後の血漿中メトロニダゾール濃度はいずれの製剤もほぼ定常状態であった。
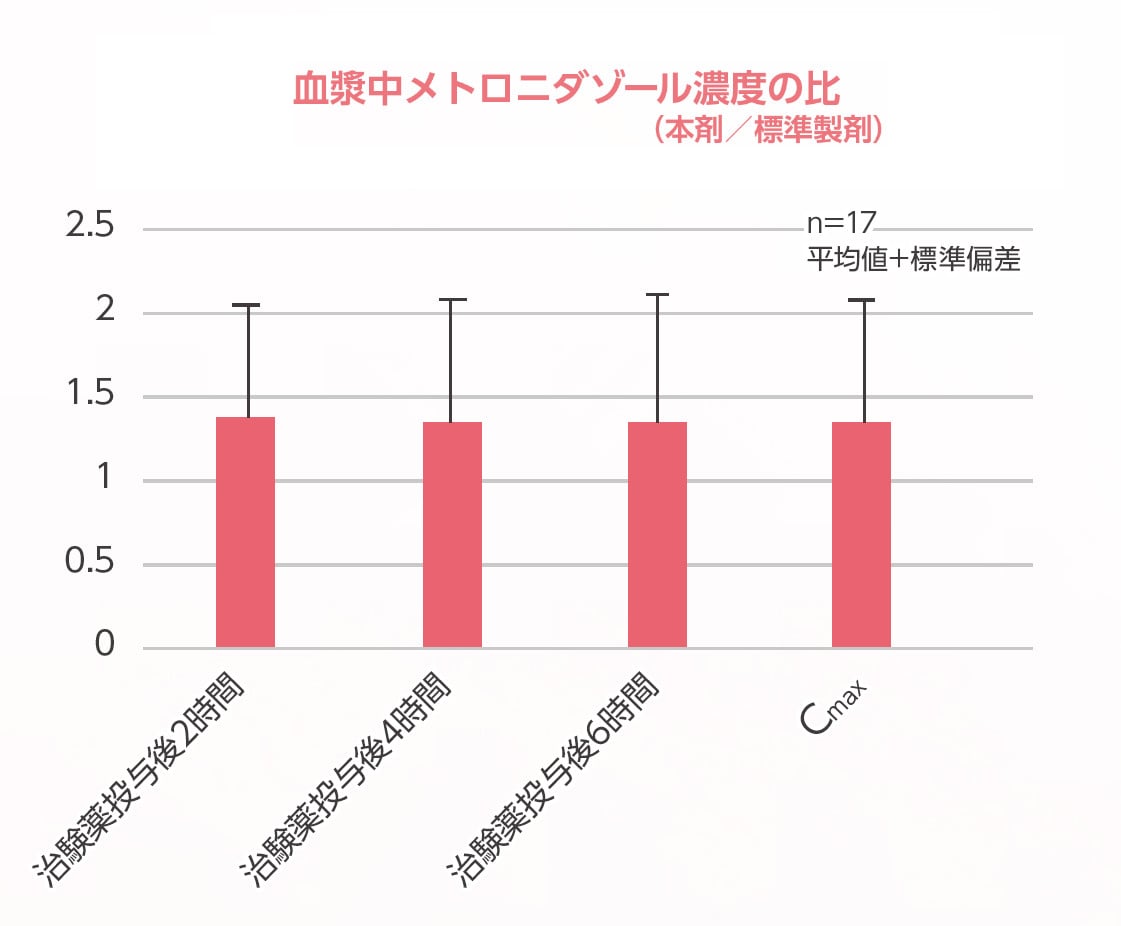
最高血漿中濃度の標準製剤に対する本剤の比は以下のグラフのとおりであった。
患者ごとの最高血漿中濃度の標準製剤に対する本剤の比は1前後であった。
血漿中メトロニダゾールの薬物動態パラメータ
| 標準製剤 | 本剤 | ||
|---|---|---|---|
| Cmax (ng/mL) |
平均値±標準偏差 (例数) |
303.650±365.357 (n=17) |
305.078±297.342 (n=17) |
| 中央値 [最小~最大] |
190.500 [5.881~1112.000] |
253.000 [5.175~871.000] |
|
| Tmax (時間) |
平均値±標準偏差 (例数) |
3.9±1.7 (n=17) |
3.4±1.7 (n=17) |
| 中央値 [最小~最大] |
4.0 [2.0~6.0] |
2.0 [2.0~6.0] |
|
2) 安全性評価 【安全性解析対象集団】
安全性
副作用は標準製剤投与時に2/20例(10.0%)、本剤投与時に1/19例(5.3%)認められた。
標準製剤投与時では接触皮膚炎、肝酵素上昇が各1例(5.0%)、本剤投与時では乳腺炎1例(5.3%)であった。
投与中止に至った有害事象、死亡例を含む重篤な有害事象は認められなかった。
3) その他の評価
においの評価:医療従事者を対象としたにおいの評価
標準製剤及び本剤のいずれにおいても「0:においがない」と評価した医療従事者が最多となった(12例(63.2 %)及び15例(78.9 %))。
においの評価スコア頻度
| においの評価 | 検定結果* | ||||||
|---|---|---|---|---|---|---|---|
| 0 | 1 | 2 | 3 | 4 | |||
| においがない | においはあるが不快ではない (皮膚潰瘍の近傍[20cm]でわずかに臭う) |
軽度に不快なにおい (皮膚潰瘍の近傍で明らかに臭う) |
中等度に不快なにおい (ベッドサイドで臭う) |
非常に不快なにおい (部屋に入ると臭う) |
|||
| 標準製剤 | 12 (63.2%) |
5 (26.3%) |
2 (10.5%) |
0 (0%) |
0 (0%) |
||
| 本剤 | 15 (78.9%) |
3 (15.8%) |
1 (5.3%) |
0 (0%) |
0 (0%) |
||
| 同一患者内での評価の変化※ | -1 | 0 | p=0.1250 | ||||
| 4 (21.1%) |
15 (78.9%) |
||||||
※評価の変化:標準製剤の評価 → 本剤の評価(本剤の評価スコアから標準製剤のスコアを引いた値)
*:Wilcoxon signed rank test、名目上のp値
【参考情報】
使用感評価
保形性、はがしやすさ、洗い落としやすさ及び総合した使用感について評価を行った結果、以下の表のとおりであった。本剤の方が使用中に患部から流れ落ちにくい傾向がみられたが、いずれの項目においても標準製剤と本剤で有意差はみられなかった。
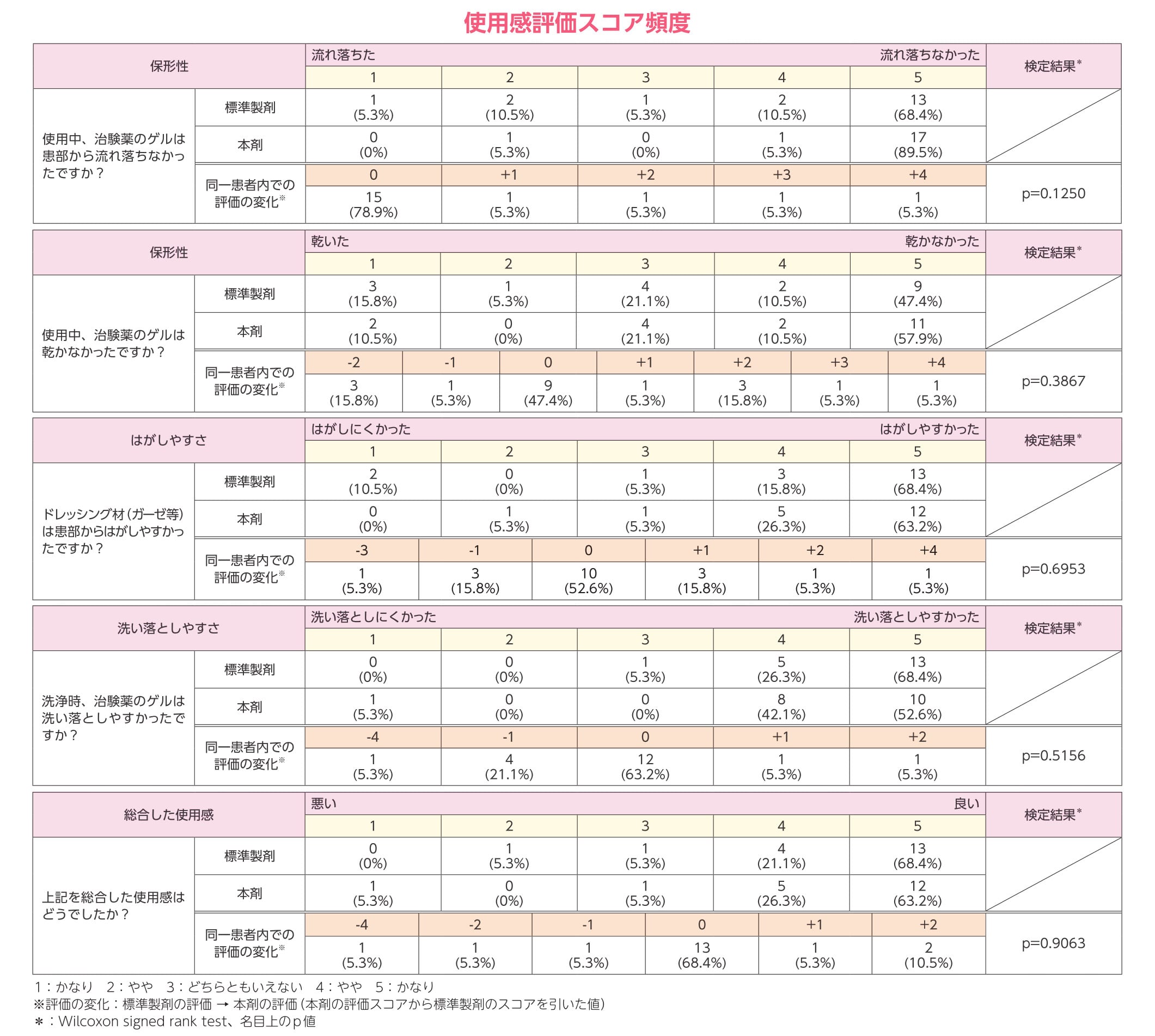
使用感評価スコア頻度
| 保形性 | 流れ落ちた | 流れ落ちなかった | 検定結果* | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | ||||||||||||||
| 使用中、治験薬のゲルは患部から流れ落ちなかったですか? | 標準製剤 | 1 (5.3%) |
2 (10.5%) |
1 (5.3%) |
2 (10.5%) |
13 (68.4%) |
||||||||||||
| 本剤 | 0 (0%) |
1 (5.3%) |
0 (0%) |
1 (5.3%) |
17 (89.5%) |
|||||||||||||
| 同一患者内での評価の変化※ | 0 | +1 | +2 | +3 | +4 | p=0.1250 | ||||||||||||
| 15 (78.9%) |
1 (5.3%) |
1 (5.3%) |
1 (5.3%) |
1 (5.3%) |
||||||||||||||
| 保形性 | 乾いた | 乾かなかった | 検定結果* | |||||||||||||||
| 1 | 2 | 3 | 4 | 5 | ||||||||||||||
| 使用中、治験薬のゲルは乾かなかったですか? | 標準製剤 | 3 (15.8%) |
1 (5.3%) |
4 (21.1%) |
2 (10.5%) |
9 (47.4%) |
||||||||||||
| 本剤 | 2 (10.5%) |
0 (0%) |
4 (21.1%) |
2 (10.5%) |
11 (57.9%) |
|||||||||||||
| 同一患者内での評価の変化※ | -2 | -1 | 0 | +1 | +2 | +3 | +4 | p=0.3867 | ||||||||||
| 3 (15.8%) |
1 (5.3%) |
9 (47.4%) |
1 (5.3%) |
3 (15.8%) |
1 (5.3%) |
1 (5.3%) |
||||||||||||
| はがしやすさ | はがしにくかった | はがしやすかった | 検定結果* | |||||||||||||||
| 1 | 2 | 3 | 4 | 5 | ||||||||||||||
| ドレッシング材(ガーゼ等)は患部からはがしやすかったですか? | 標準製剤 | 2 (10.5%) |
0 (0%) |
1 (5.3%) |
3 (15.8%) |
13 (68.4%) |
||||||||||||
| 本剤 | 0 (0%) |
1 (5.3%) |
1 (5.3%) |
5 (26.3%) |
12 (63.2%) |
|||||||||||||
| 同一患者内での評価の変化※ | -3 | -1 | 0 | +1 | +2 | +4 | p=0.6953 | |||||||||||
| 1 (5.3%) |
3 (15.8%) |
10 (52.6%) |
3 (15.8%) |
1 (5.3%) |
1 (5.3%) |
|||||||||||||
| 洗い落としやすさ | 洗い落としにくかった | 洗い落としやすかった | 検定結果* | |||||||||||||||
| 1 | 2 | 3 | 4 | 5 | ||||||||||||||
| 洗浄時、治験薬のゲルは洗い落としやすかったですか? | 標準製剤 | 0 (0%) |
0 (0%) |
1 (5.3%) |
5 (26.3%) |
13 (68.4%) |
||||||||||||
| 本剤 | 1 (5.3%) |
0 (0%) |
0 (0%) |
8 (42.1%) |
10 (52.6%) |
|||||||||||||
| 同一患者内での評価の変化※ | -4 | -1 | 0 | +1 | +2 | p=0.5156 | ||||||||||||
| 1 (5.3%) |
4 (21.1%) |
12 (63.2%) |
1 (5.3%) |
1 (5.3%) |
||||||||||||||
| 総合した使用感 | 悪い | 良い | 検定結果* | |||||||||||||||
| 1 | 2 | 3 | 4 | 5 | ||||||||||||||
| 上記を総合した使用感はどうでしたか? | 標準製剤 | 0 (0%) |
1 (5.3%) |
1 (5.3%) |
4 (21.1%) |
13 (68.4%) |
||||||||||||
| 本剤 | 1 (5.3%) |
0 (0%) |
1 (5.3%) |
5 (26.3%) |
12 (63.2%) |
|||||||||||||
| 同一患者内での評価の変化※ | -4 | -2 | -1 | 0 | +1 | +2 | p=0.9063 | |||||||||||
| 1 (5.3%) |
1 (5.3%) |
1 (5.3%) |
13 (68.4%) |
1 (5.3%) |
2 (10.5%) |
|||||||||||||
1:かなり 2:やや 3:どちらともいえない 4:やや 5:かなり
※評価の変化:標準製剤の評価 → 本剤の評価(本剤の評価スコアから標準製剤のスコアを引いた値)
*:Wilcoxon signed rank test、名目上のp値
先発医薬品と"効能又は効果"に違いはありますか。
先発医薬品と"効能又は効果"に違いがございます。メトロニダゾールゲル0.75%「マルイシ」は「がん性皮膚潰瘍部位の殺菌·臭気の軽減」の効能又は効果となり、「酒さ」の適応はございません。
薬価を教えてください。
37.50円/gです。(2024年12月6日時点)
発売日はいつですか。
2025年3月3日です。
※製品のご使用に際しましては、最新の電子添文をご確認ください。
電子添文情報等を確認